网址:http://m.1010jiajiao.com/timu3_id_154611[举报]
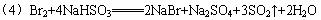
①装置如图所示,检查其气密性。
②向仪器Ⅰ中加入一定体积的水和浓H2SO4,冷却至室温。然后,向仪器Ⅰ中加入一定量的乙醇及研细的溴化钠。充分振荡,混合均匀,并加入沸石(或碎瓷片)。
③将仪器Ⅰ置于石棉网上用小火加热,直至反应结束。此时仪器Ⅱ中已有一定量的液体。
④继续加热直至仪器Ⅰ中的油状液体消失。
⑤将所得到的粗产品依次用水、饱和碳酸氢钠溶液洗涤,最后再用蒸馏水洗涤。
⑥用无水氯化钙干燥后进行蒸馏,得纯溴乙烷。
(1)仪器Ⅰ起两个作用,除了作反应容器,还充当了_____________(仪器)的作用。
(2)步骤②中要在室温下并且在浓H2SO4稀释后才加入溴化钠的原因是:________________。
(3)步骤③中,为什么只能用小火加热,试写出两种不同类型的原因:①________________,②_______________________________________。
(4)步骤⑤中粗产品用水洗涤后,发现有机层仍呈红棕色,为了除去该杂质,可加入饱和亚硫酸氢钠,反应后有二氧化硫生成。试写出该反应的化学方程式:
___________________________________________________________。
(5)装置Ⅰ中的长导管的作用是_____________________________;装置Ⅱ中加入冰的作用是__________________________________________。
查看习题详情和答案>>实验室制备溴乙烷(CH3CH2Br,沸点38.4 ℃)的主要步骤如下:
①装配如图所示装置,检查其气密性。
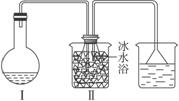
图1-14-5
②向仪器Ⅰ中加入一定体积的水和浓H2SO4,冷却至室温。然后,向仪器Ⅰ中加入一定量的乙醇及研细的溴化钠。充分振荡,混合均匀,并加入沸石(或碎瓷片)。
③将仪器Ⅰ置于石棉网上用小火加热,直至反应结束。此时仪器Ⅱ中已有一定数量的液体。
④继续加热直至仪器Ⅰ中的油状液体消失。
⑤将所得到的粗产品依次用水、饱和碳酸氢钠溶液洗涤,最后再用蒸馏水洗涤。
⑥用无水氯化钙干燥后进行蒸馏,得纯溴乙烷。
(1)仪器Ⅰ起了两个作用,除了作反应容器,还充当了_______________(仪器)的作用。
(2)步骤②中要在室温下并且在浓H2SO4稀释后才加入溴化钠的原因是__________________。
(3)步骤③中,为什么只能用小火加热,试写出两种不同类型的原因:①__________________,②___________________________。
(4)步骤⑤中粗产品用水洗涤后,发现有机层仍呈红棕色,为了除去该杂质,可加入饱和亚硫酸氢钠除去,反应后有二氧化硫生成。试写出该反应的化学方程式___________________。
(5)装置Ⅰ中的长玻璃管的作用是______________________________________;仪器Ⅱ中加入冰的作用是______________________________________________________________。
查看习题详情和答案>>①加热NaNO2(一种致癌物质,有毒)与NH4Cl的混合物浓溶液制取N2;
②将空气通过灼热的活性铜粉制得较纯净的N2;
③加热条件下用NH3还原CuO得纯净的N2和活性铜粉.
如图所示,给出了按上述途径制取N2可供选择的几种实验装置:

请回答下列问题:
(1)按途径①制取N2时,应选用上述装置中的
(2)若只需较纯净的N2,有同学建议把②和③两条途径协同使用,这样做的好处是
(3)按途径③制取N2时,若气流从左到右的顺序所需的上述装置是:A→C→B→D.在A装置中所需要的试剂是
①甲同学:为通过实验现象验证C处有水产生,必须在C装置前后都连接E装置,其中填充的固体药品按前后顺序分别为
②乙同学:实验过程中,发现黑色固体完全变红,质疑此时红色固体可能含Cu2O.通过查阅资料知:Cu2O+2H+=Cu2++Cu+H2O.依据信息,请设计实验证明C处的红色固体中是否含有Cu2O:
③丙同学:实验时充分加热,至C装置硬质玻管质量不再减轻为止.实验完毕后,若实验测得收集的N2体积为aL(已折算为标准状况),硬质玻管质量减轻了bg.则氨分子中氮、氢的原子个数比为(用含a、b的字母的代数式表示)
| 16a |
| 22.4b |
| 16a |
| 22.4b |
(4)目前工业上用氮气和氢气直接合成氨,氨经一系列反应可制得硝酸.在以上各步反应中,按要求完成化学反应方程式:
①氮元素只发生还原反应
| 高温高压 |
| 催化剂 |
| 高温高压 |
| 催化剂 |
②氮元素既发生氧化反应又发生还原反应:
方法一:将氨气通过灼热的氧化铜粉末,得到氮气和铜等。
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末。
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,逸出氮气。
方法一有关装置如下图所示(其中有些仪器如:铁架台、铁夹、铁圈、石棉网、酒精灯等未画出):
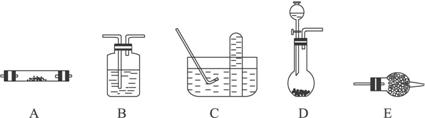
请回答下列问题:
(1)方法一制氮气:氨气是用浓氨水跟生石灰反应得到,应选用__________(填编号)作发生装置,该反应的化学方程式为______________________________。要制取并收集较纯净的氮气(可含有少量的水),还应使用上述装置中的(填装置的编号,并按气流方向从左向右列出)_____________________________________________________________________。
(2)制取氮气的三种方法中,方法一和方法二越来越受到人们的关注,经常被联合使用。这两种方法与方法三相比,其优越性在于______________________________。
查看习题详情和答案>>实验室模拟合成氨和氨催化氧化的流程如下:
 | |||||
 | |||||
 | |||||


已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从上图中选择制取气体的合适装置:
氮气 、氢气 。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 、 。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨, (填“会”或“不会”)发生倒吸,原因是: 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(5)写出乙装置中氨氧化的化学方程式: 。
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
(B)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
 |
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于
 上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:A.蒸发皿 B.石棉网 C.泥三角 D.表面皿 E.坩埚钳 F.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是 。
A.灼烧过程中部分氧化铜被还原 B.灼烧不充分铜未被完全氧化
C.氧化铜在加热过程中分解生成铜 D.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是: 、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行
次。
(6)若测定结果x值偏高,可能的原因是 。
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
查看习题详情和答案>>