网址:http://m.1010jiajiao.com/timu3_id_154514[举报]
选做题
本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,每题12分。请选择其中一题作答,若两题都作答,则以A题得分计入总分。
20A.过渡元素在生活、生产和科技等方面有广泛的用途。
(1)应用于合成氨反应的催化剂(铁)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则图示铁颗粒表面上氮原子与铁原子的个数比为 。

(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是 。(填序号)
A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
| 元素 | Mn | Fe | |
| 电离能 (kJ・mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬(Ⅲ)与甲基丙烯酸根的配合物为:
①该化合物中存在的化学键类型有 。
②该化合物中一个Cr的配位数为 。
③甲基丙烯酸分子中C原子的杂化方式有 。
④等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是 。(填一种即可)
⑤与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是
____ 。(填元素符号)
 |
20B.阿斯匹林(乙酰水杨酸)是由水杨酸和乙酸酐合成的:
在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150mL干燥锥形瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85℃~90℃条件下反应5~10 min,然后冷却,即有乙酰水杨酸晶体析出。
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL饱和碳酸氢钠溶液,加完后继续搅拌2~3 min,直到没有二氧化碳气体产生为止。过滤,用5~10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4mol / L盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1~2次,再抽干水分,即得产品。
(1)第①步中,要控制温度在85℃~90℃,应采用的加热方法是 ,用这种方法加热需要的玻璃仪器有 。
(2)在第②步中,用冷水洗涤晶体,其目的是 、 。
(3)在第③步中,加入饱和碳酸氢钠溶液的作用是 ,加入盐酸的作用是 。
(4)如何检验产品中是否混有水杨酸? 。
查看习题详情和答案>>
选做题
本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,每题12分。请选择其中一题作答,若两题都作答,则以A题得分计入总分。
20A.过渡元素在生活、生产和科技等方面有广泛的用途。
(1)应用于合成氨反应的催化剂(铁)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则图示铁颗粒表面上氮原子与铁原子的个数比为 。

(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是 。(填序号)
A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
|
元素 |
Mn |
Fe |
|
|
电离能 (kJ・mol-1) |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬(Ⅲ)与甲基丙烯酸根的配合物为:

①该化合物中存在的化学键类型有 。
②该化合物中一个Cr的配位数为 。
③甲基丙烯酸分子中C原子的杂化方式有 。
④等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是 。(填一种即可)
⑤与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是
____ 。(填元素符号)
 |
20B.阿斯匹林(乙酰水杨酸)是由水杨酸和乙酸酐合成的:
在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150 mL干燥锥形瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85℃~90℃条件下反应5~10 min,然后冷却,即有乙酰水杨酸晶体析出。
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL饱和碳酸氢钠溶液,加完后继续搅拌2~3 min,直到没有二氧化碳气体产生为止。过滤,用5~10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4mol / L盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1~2次,再抽干水分,即得产品。
(1)第①步中,要控制温度在85℃~90℃,应采用的加热方法是 ,用这种方法加热需要的玻璃仪器有 。
(2)在第②步中,用冷水洗涤晶体,其目的是 、 。
(3)在第③步中,加入饱和碳酸氢钠溶液的作用是 ,加入盐酸的作用是 。
(4)如何检验产品中是否混有水杨酸? 。
查看习题详情和答案>>
(选做题)(19分)图表法、模型法是常用的科学研究方法。
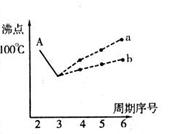
I.下图是研究部分元素的氢化物的沸点变化规律的图像。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b(其中A点对应的沸点是100℃),你认为正确的是 ,理由是 。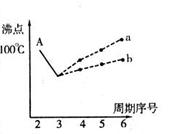
II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的价电子层排布式为 。
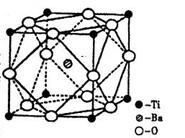
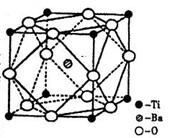
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,价电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是 。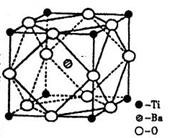
III.上世纪60年化,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对情性”的观念。在随后的几年内,科学家又相继后成了氙的氟化物、氧化物等。
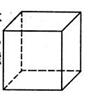
(1)金属Pt内部原子的堆积方式与铜及干冰中的CO2相同,右图正方体是Pt晶胞的示意图,试说出Pt原子在晶胞中的位置 。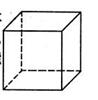
(2)稀有气体(氡除外)中,只有较重的氙能合成出多种化合物,
其可能原因是 (填字母代号)
| A.氙的含量比较丰富 | B.氙的相对原子质量大 |
| C.氙原子半径大,电离能小 | D.氙原子半径小,电负性大 |
(选做题)图表法、模型法是常用的科学研究方法。
I.下图是研究部分元素的氢化物的沸点变化规律的图像。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b(其中A点对应的沸点是100℃),你认为正确的是 ,理由是 。
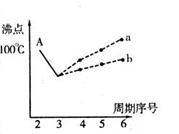
II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的价电子层排布式为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,价电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是 。
III.上世纪60年化,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对情性”的观念。在随后的几年内,科学家又相继后成了氙的氟化物、氧化物等。
(1)金属Pt内部原子的堆积方式与铜及干冰中的CO2相同,右图正方体是Pt晶胞的示意图,试说出Pt原子在晶胞中的位置 。
(2)稀有气体(氡除外)中,只有较重的氙能合成出多种化合物,
其可能原因是 (填字母代号)
A.氙的含量比较丰富 B.氙的相对原子质量大
C.氙原子半径大,电离能小 D.氙原子半径小,电负性大
(3)已知XeO3分子中氙原子上有1对弧对电子,则XeO3为 分子(填“极性”或“非极性”)。
查看习题详情和答案>>I.下图是研究部分元素的氢化物的沸点变化规律的图像。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b(其中A点对应的沸点是100℃),你认为正确的是 ,理由是 。
II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的价电子层排布式为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,价电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是 。
III.上世纪60年化,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对情性”的观念。在随后的几年内,科学家又相继后成了氙的氟化物、氧化物等。
(1)金属Pt内部原子的堆积方式与铜及干冰中的CO2相同,右图正方体是Pt晶胞的示意图,试说出Pt原子在晶胞中的位置 。

(2)稀有气体(氡除外)中,只有较重的氙能合成出多种化合物,
其可能原因是 (填字母代号)
| A.氙的含量比较丰富 | B.氙的相对原子质量大 |
| C.氙原子半径大,电离能小 | D.氙原子半径小,电负性大 |