摘要:pH的测定方法 用玻璃棒蘸被子测溶液在pH试纸上.把试纸的颜色与标准比色卡对照.得出溶液的pH 用pH试纸测定溶液的pH时要注意: (1)不能直接将pH试纸浸入待测溶液中.以免带入杂质.污染试剂. (2)不能将pH试纸润湿.否则.等测溶液被稀释.测量不准确. (3)用pH试纸检验酸性或碱性气体时.可将pH试纸润湿再用. [例1]结合下表中所列物质的pH判断.在下列各组物质中.分别能使紫色石蕊溶液变红.不变色.变蓝的是( ) 物质 酱油 厕所清洁剂 血浆 牙膏 肥皂水 橘汁 草木灰水 柠檬汁 pH 4.8 1.7 7.4 8.2 9.2 3.5 10.6 2.5 A.柠檬汁.食盐水.厕所清洁剂 B.牙膏.蒸馏水.肥皂水 C.草木灰.蒸馏水.柠檬汁 D.橘汁.食盐水.草木灰水 [答案]D [解析]使紫色石蕊溶液变红的是酸性溶液.不变色的是中性溶液.变蓝的是碱性溶液.厕所清洁剂的pH为1.7.显酸性.使紫色石蕊试液变红色.所以A错误.牙膏的pH为8.2.显碱性.使紫色石蕊试液变蓝.所以B错误.草木灰和柠檬汁的pH分别为10.6和2.5.分别使紫色石蕊试液变蓝和变红.所以D不正确. [规律小结]pH=7.溶液呈中性.遇到无色酚酞试液和紫色石蕊试液均不变色,pH<7.溶液呈酸性.可以使紫色石蕊试液变红色.遇无色酚酞试液不变色,pH>7.溶液呈碱性.可以是紫色石蕊试液变蓝色.使无色酚酞试液变红色. 变式训练一
网址:http://m.1010jiajiao.com/timu3_id_15441[举报]
(2006?玄武区一模)酸雨是pH小于5.6的降水.我国大部分地区所降酸雨主要是由居民和工厂燃烧含硫的煤以及某些化工厂生产过程中排放的二氧化硫气体,经过一系列化学反应而形成的.
(1)如果硫粉在氧气中燃烧,观察到的现象是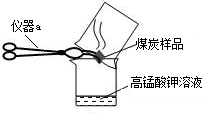
,该反应的化学方程式为
(2)几位同学为了探究木炭中是否含有少量硫元素,他们设计了如图所示实验进行测定.请写出图中仪器a的名称:
“5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2 ”.然而化学方程式中最后一种物质的化学式印刷不清楚,根据上下文了解到该物质是一种酸,请根据已学知识推测其化学式:
”.然而化学方程式中最后一种物质的化学式印刷不清楚,根据上下文了解到该物质是一种酸,请根据已学知识推测其化学式:
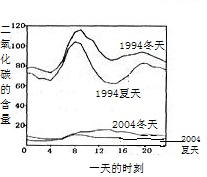
(3)如图是1994年和2004年某城市的一天各个时刻测到的空气中二氧化硫的含量.下列说法不正确的是
A.曲线显示冬天大气中的二氧化硫含量比夏天高
B.曲线显示了1994年一天中大约8点左右二氧化硫的含量较高
C.二氧化硫的含量在10年间降低的原因可能是加强了燃料的脱硫和控制了二氧化硫的排放
D.二氧化硫污染的主要来源是汽车排放的尾气,控制污染的方法是禁止使用汽车
(4)在研究酸雨危害的过程中,测定该地区雨水的pH的实验操作
某化学兴趣小组取刚降到地面的雨水,每隔一定时间用较精密的pH计测定其pH,数据如下:
由此可知该雨水的酸性越来越
(5)酸雨造成的危害很多.某兴趣小组调查发现南京的六朝石刻的表面有不同程度的腐蚀.且近20年的腐蚀速度大大超过以往,其中最主要原因之一就是酸雨.为了减缓石刻腐蚀,请你提一条建议:
酸雨还会使土壤酸化.为了中和酸性土壤,可以使用熟石灰粉末,若该酸雨的成分是硫酸,请写出该中和反应的化学方程式
(6)某校化学兴趣小组在学完碱的化学性质后,想到用NaOH溶液吸收SO2,反应化学方程式如下:2NaOH+SO2═Na2SO3+H2O 用NaOH溶液吸收1000L已除去CO2的空气样品,溶液质量增重了0.64g.已知此时空气的密度约为1.3g/L,求:
①被吸收的SO2的质量
②发生反应的NaOH的质量.(相对原子质量:Na-23 S-32 O-16)
③空气中SO2的质量分数(计算结果精确到0.01%).
查看习题详情和答案>>
(1)如果硫粉在氧气中燃烧,观察到的现象是
产生明亮的蓝紫色火焰,放出热量,产生一种无色有刺激性气味的气体
产生明亮的蓝紫色火焰,放出热量,产生一种无色有刺激性气味的气体


,该反应的化学方程式为
S+O2
SO2
| ||
S+O2
SO2
.
| ||
(2)几位同学为了探究木炭中是否含有少量硫元素,他们设计了如图所示实验进行测定.请写出图中仪器a的名称:
坩埚钳
坩埚钳
.他们查阅资料后得知:“二氧化硫能使KMnO4溶液褪色(由紫红色变成无色),反应方程式为:“5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2
 ”.然而化学方程式中最后一种物质的化学式印刷不清楚,根据上下文了解到该物质是一种酸,请根据已学知识推测其化学式:
”.然而化学方程式中最后一种物质的化学式印刷不清楚,根据上下文了解到该物质是一种酸,请根据已学知识推测其化学式:H2SO4
H2SO4
.反应后生成的MnSO4中Mn元素化合价为+2
+2
.(3)如图是1994年和2004年某城市的一天各个时刻测到的空气中二氧化硫的含量.下列说法不正确的是
D
D
A.曲线显示冬天大气中的二氧化硫含量比夏天高
B.曲线显示了1994年一天中大约8点左右二氧化硫的含量较高
C.二氧化硫的含量在10年间降低的原因可能是加强了燃料的脱硫和控制了二氧化硫的排放
D.二氧化硫污染的主要来源是汽车排放的尾气,控制污染的方法是禁止使用汽车
(4)在研究酸雨危害的过程中,测定该地区雨水的pH的实验操作
用玻璃棒蘸取雨水,点在试纸上,与标准比色卡对照,读取数值
用玻璃棒蘸取雨水,点在试纸上,与标准比色卡对照,读取数值
.某化学兴趣小组取刚降到地面的雨水,每隔一定时间用较精密的pH计测定其pH,数据如下:
| 测定时间/分钟 | 0 | 1 | 2 | 3 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
强
强
(填“强”或“弱”),最终趋于稳定.(5)酸雨造成的危害很多.某兴趣小组调查发现南京的六朝石刻的表面有不同程度的腐蚀.且近20年的腐蚀速度大大超过以往,其中最主要原因之一就是酸雨.为了减缓石刻腐蚀,请你提一条建议:
使用清洁能源
使用清洁能源
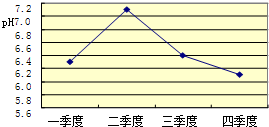
. 酸雨会使河流、湖泊酸化.下图是某市去年某河流一年中不同时期河水的平均pH变化的折线图.则去年河水酸性最强的季度是第四
四
季度.该季度雨水酸性最强的原因可能是:(答两条)冬季取暖,需要燃烧大量化石燃料,加大了对河水的污染;冬季降水量减少,河水中酸的浓度增大等
冬季取暖,需要燃烧大量化石燃料,加大了对河水的污染;冬季降水量减少,河水中酸的浓度增大等
.酸雨还会使土壤酸化.为了中和酸性土壤,可以使用熟石灰粉末,若该酸雨的成分是硫酸,请写出该中和反应的化学方程式
H2SO4+Ca(OH)2=CaSO4+2H2O
H2SO4+Ca(OH)2=CaSO4+2H2O
.
(6)某校化学兴趣小组在学完碱的化学性质后,想到用NaOH溶液吸收SO2,反应化学方程式如下:2NaOH+SO2═Na2SO3+H2O 用NaOH溶液吸收1000L已除去CO2的空气样品,溶液质量增重了0.64g.已知此时空气的密度约为1.3g/L,求:
①被吸收的SO2的质量
0.64g
0.64g
g.②发生反应的NaOH的质量.(相对原子质量:Na-23 S-32 O-16)
③空气中SO2的质量分数(计算结果精确到0.01%).
(2012?潍坊一模)(1)2011年4月26日,全省最大的啤酒生产企业重啤集团盐城公司20万千升重啤项目正式投料生产.
①公司花园式的厂区里飘溢着阵阵麦芽香味.用微观粒子知识解释能闻到香味的原因
②啤酒酿造过程中,酵母是“魔术师”,能将麦芽汁转化为酒精和二氧化碳.该变化属于
③啤酒酿造需要大量软水.硬水软化是指除去硬水中的
④啤酒呈微酸性,过期的啤酒可用来浇灌喜酸花卉.测定啤酒的酸碱度可用
⑤啤酒贮存和运输时要防止阳光暴晒,原因是
(2)分类学习是化学学习中常用的方法,通过按一定标准分类研究,往往可以收到事半功倍的效果.
①我们在初中阶段将化合物简单分为氧化物、酸、碱、盐等.根据盐的组成里所含阴、阳离子的特点,可进一步将盐分类并称为某盐.例如,组成里含有碳酸根离子的盐称为碳酸盐,含有钾离子的盐称为钾盐,含有铵根离子的盐称为铵盐….则CaCO3、Na2CO3、K2CO3等盐都属于
②物质燃烧需要三个条件:可燃物、
③仅含碳和氢两种元素的有机物称为烃,如烷烃、烯烃、炔烃等.烷烃中最简单的是甲烷(CH4),其余随碳原子数的增加,依次为乙烷(C2H6)、丙烷(C3H8)、丁烷(C4H10)等.如果烷烃中的碳原子数为n,则烷烃的化学式可以用通式
查看习题详情和答案>>
①公司花园式的厂区里飘溢着阵阵麦芽香味.用微观粒子知识解释能闻到香味的原因
分子在不断运动
分子在不断运动
.②啤酒酿造过程中,酵母是“魔术师”,能将麦芽汁转化为酒精和二氧化碳.该变化属于
化学
化学
变化(选填“物理”或“化学”),酵母的作用是催化
催化
.③啤酒酿造需要大量软水.硬水软化是指除去硬水中的
钙、镁化合物(或钙、镁离子)
钙、镁化合物(或钙、镁离子)
,实验室常用肥皂水
肥皂水
试剂区别软水和硬水.④啤酒呈微酸性,过期的啤酒可用来浇灌喜酸花卉.测定啤酒的酸碱度可用
pH试纸
pH试纸
,测定方法用玻璃棒蘸取啤酒滴在pH试纸上,把试纸显示的颜色与标准比色卡对照,
用玻璃棒蘸取啤酒滴在pH试纸上,把试纸显示的颜色与标准比色卡对照,
即可得到啤酒的pH
即可得到啤酒的pH
.⑤啤酒贮存和运输时要防止阳光暴晒,原因是
防止温度升高,气体溶解度减小,CO2气体溢出,使瓶内压强变大,
防止温度升高,气体溶解度减小,CO2气体溢出,使瓶内压强变大,
导致瓶子爆裂
导致瓶子爆裂
.(2)分类学习是化学学习中常用的方法,通过按一定标准分类研究,往往可以收到事半功倍的效果.
①我们在初中阶段将化合物简单分为氧化物、酸、碱、盐等.根据盐的组成里所含阴、阳离子的特点,可进一步将盐分类并称为某盐.例如,组成里含有碳酸根离子的盐称为碳酸盐,含有钾离子的盐称为钾盐,含有铵根离子的盐称为铵盐….则CaCO3、Na2CO3、K2CO3等盐都属于
碳酸盐
碳酸盐
;它们都能与稀盐酸反应生成二氧化碳(或CO2)
二氧化碳(或CO2)
气体,请写出其中一个反应的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.②物质燃烧需要三个条件:可燃物、
与氧气(或O2、或空气)接触
与氧气(或O2、或空气)接触
、温度达到着火点,这三个条件缺一不可,因此,只要破坏燃烧的条件,就可以实现灭火.请任举一例灭火的具体方法:油锅着火用锅盖盖灭
油锅着火用锅盖盖灭
.铁在潮湿的空气中易生锈,实际上是铁与空气中的氧气
氧气
、水蒸气等发生化学反应的过程,同理,只要破坏铁制品锈蚀的条件,就能防锈,请任举一例防止铁制品锈蚀的具体方法:喷漆
喷漆
.③仅含碳和氢两种元素的有机物称为烃,如烷烃、烯烃、炔烃等.烷烃中最简单的是甲烷(CH4),其余随碳原子数的增加,依次为乙烷(C2H6)、丙烷(C3H8)、丁烷(C4H10)等.如果烷烃中的碳原子数为n,则烷烃的化学式可以用通式
CnH2n+2
CnH2n+2
表示.它们在氧气中完全燃烧的产物都是二氧化碳和水,试写出丙烷在空气中充分燃烧的化学方程式C3H8+5O2
3CO2+4H2O
| ||
. |
C3H8+5O2
3CO2+4H2O
.
| ||
. |
酸雨是pH小于5.6的降水.我国大部分地区所降酸雨主要是由居民和工厂燃烧含硫的煤以及某些化工厂生产过程中排放的二氧化硫气体,经过一系列化学反应而形成的.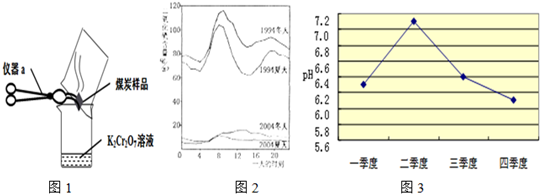
(1)如果硫粉在氧气中燃烧,观察到的现象是
(2)几位同学为了探究木炭中是否含有少量硫元素,他们设计了如图1所示实验进行测定.请写出图中仪器a的名称: +H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:
+H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:
(3)如图2是1994年和2004年某城市的一天各个时刻测到的空气中二氧化硫的含量.下列说法不正确的是
A.曲线显示冬天大气中的二氧化硫含量比夏天高
B.曲线显示了1994年一天中大约8点左右二氧化硫的含量较高
C.二氧化硫的含量在10年间降低的原因可能是加强了燃料的脱硫和控制了二氧化硫的排放
D.二氧化硫污染的主要来源是汽车排放的尾气,控制污染的方法是禁止使用汽车
(4)在研究酸雨危害的过程中,测定该地区雨水的pH的实验操作
某化学兴趣小组取刚降到地面的雨水,每隔一定时间用较精密的pH计测定其pH,数据如下:
由此可知该雨水的酸性越来越
(5)酸雨造成的危害很多.某兴趣小组调查发现某市的石刻的表面有不同程度的腐蚀.且近20年的腐蚀速度大大超过以往,其中最主要原因之一就是酸雨.为了减缓石刻腐蚀,请你提一条建议:
酸雨还会使土壤酸化.为了中和酸性土壤,可以使用熟石灰粉末,若该酸雨的成分是硫酸,请写出该中和反应的化学方程式
(6)某校化学兴趣小组在学完碱的化学性质后,想到用NaOH溶液吸收SO2,反应化学方程式如下:2NaOH+SO2═Na2SO3+H2O 用NaOH溶液吸收1000L已除去CO2的空气样品,溶液质量增重了0.64g.已知此时空气的密度约为1.3g/L,求:
①被吸收的SO2的质量
②发生反应的NaOH的质量.(相对原子质量:Na-23 S-32 O-16)
③空气中SO2的质量分数(计算结果精确到0.01%).
查看习题详情和答案>>

(1)如果硫粉在氧气中燃烧,观察到的现象是
剧烈燃烧,放出热量,产生明亮的蓝紫色火焰,产生一种无色有刺激性气味的气体
剧烈燃烧,放出热量,产生明亮的蓝紫色火焰,产生一种无色有刺激性气味的气体
,该反应的化学方程式为S+O2
SO2
| ||
S+O2
SO2
.
| ||
(2)几位同学为了探究木炭中是否含有少量硫元素,他们设计了如图1所示实验进行测定.请写出图中仪器a的名称:
坩埚钳
坩埚钳
.他们查阅资料后得知:“二氧化硫能使K2Cr2O7溶液褪色(由橙红色变成绿色),反应方程式为:“3SO2+K2Cr2O7+H2SO4═K2SO4+ +H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:
+H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:Cr2(SO4)3
Cr2(SO4)3
.反应前K2Cr2O7中Cr元素化合价为+6
+6
价.(3)如图2是1994年和2004年某城市的一天各个时刻测到的空气中二氧化硫的含量.下列说法不正确的是
D
D
A.曲线显示冬天大气中的二氧化硫含量比夏天高
B.曲线显示了1994年一天中大约8点左右二氧化硫的含量较高
C.二氧化硫的含量在10年间降低的原因可能是加强了燃料的脱硫和控制了二氧化硫的排放
D.二氧化硫污染的主要来源是汽车排放的尾气,控制污染的方法是禁止使用汽车
(4)在研究酸雨危害的过程中,测定该地区雨水的pH的实验操作
用玻璃棒蘸取雨水,点在试纸上,与标准比色卡对照,读取数值
用玻璃棒蘸取雨水,点在试纸上,与标准比色卡对照,读取数值
.某化学兴趣小组取刚降到地面的雨水,每隔一定时间用较精密的pH计测定其pH,数据如下:
| 测定时间/分钟 | 0 | 1 | 2 | 3 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
强
强
(填“强”或“弱”),最终趋于稳定.可能的原因是雨水中的H2SO3被氧气氧化为H2SO4,化学方程式为2H2SO3+O2=2H2SO4
2H2SO3+O2=2H2SO4
.(5)酸雨造成的危害很多.某兴趣小组调查发现某市的石刻的表面有不同程度的腐蚀.且近20年的腐蚀速度大大超过以往,其中最主要原因之一就是酸雨.为了减缓石刻腐蚀,请你提一条建议:
使用清洁能源
使用清洁能源
.酸雨会使河流、湖泊酸化.如图3是某市去年某河流一年中不同时期河水的平均pH变化的折线图.则去年河水酸性最强的季度是第四
四
季度.该季度雨水酸性最强的原因可能是:(答两条)冬季取暖,需要燃烧大量化石燃料,加大了对河水的污染
冬季取暖,需要燃烧大量化石燃料,加大了对河水的污染
;冬季降水量减少,河水中酸的浓度增大
冬季降水量减少,河水中酸的浓度增大
.酸雨还会使土壤酸化.为了中和酸性土壤,可以使用熟石灰粉末,若该酸雨的成分是硫酸,请写出该中和反应的化学方程式
H2SO4+Ca(OH)2=CaSO4+2H2O
H2SO4+Ca(OH)2=CaSO4+2H2O
.(6)某校化学兴趣小组在学完碱的化学性质后,想到用NaOH溶液吸收SO2,反应化学方程式如下:2NaOH+SO2═Na2SO3+H2O 用NaOH溶液吸收1000L已除去CO2的空气样品,溶液质量增重了0.64g.已知此时空气的密度约为1.3g/L,求:
①被吸收的SO2的质量
0.8
0.8
g.②发生反应的NaOH的质量.(相对原子质量:Na-23 S-32 O-16)
③空气中SO2的质量分数(计算结果精确到0.01%).
魔芋是天南星科多年生草本植物,具有行於散结,解毒消肿等功效.魔芋所含的有效成分葡甘聚糖还有降血脂、降血糖、减肥等作用.我市有些地方盛产魔芋.小明同学善于观察生活并能勤于思考,他的妈妈告诉他:魔芋在生长期不能施草木灰做肥料,否则魔芋难于生长.
提出问题:魔芋与草木灰为什么不相容?
实验探究:(1)获取魔芋汁和草木灰水.取来魔芋,切成小片,放入研钵研压,加入少量蒸馏水,然后
(2)测魔芋汁和草木灰水的PH.测其PH的操作是
(3)取少量魔芋汁于试管里,加入少量草木灰水,观察到魔芋汁慢慢凝聚成豆腐状.再取魔芋汁于另一试管里,加入少量氢氧化钠溶液,观察到同样的现象.做后一步实验的目的是
获得的结论是
我还想再探究的一个新问题是:
查看习题详情和答案>>
提出问题:魔芋与草木灰为什么不相容?
实验探究:(1)获取魔芋汁和草木灰水.取来魔芋,切成小片,放入研钵研压,加入少量蒸馏水,然后
搅拌
搅拌
,得到魔芋汁;将草木灰放入烧杯中,加入少量蒸馏水,搅拌,静置,然后过滤
过滤
,得到草木灰水.(2)测魔芋汁和草木灰水的PH.测其PH的操作是
用玻璃棒蘸取待测溶液,滴在试纸上,然后再与标准比色卡对照,便可测出溶液的pH
用玻璃棒蘸取待测溶液,滴在试纸上,然后再与标准比色卡对照,便可测出溶液的pH
,测得魔芋汁的PH为7,则它呈中
中
性,草木灰水PH为10,则它呈碱
碱
性.(3)取少量魔芋汁于试管里,加入少量草木灰水,观察到魔芋汁慢慢凝聚成豆腐状.再取魔芋汁于另一试管里,加入少量氢氧化钠溶液,观察到同样的现象.做后一步实验的目的是
验证魔芋汁能与碱性物质反应
验证魔芋汁能与碱性物质反应
.获得的结论是
魔芋与草木灰不相容
魔芋与草木灰不相容
.我还想再探究的一个新问题是:
魔芋能否与酸性物质作用
魔芋能否与酸性物质作用
.(2013?黔东南州)某同学在学习溶液的酸碱性时发现盐溶液NaCl呈中性Na2CO3溶液呈碱性,该同学认为有可能有的盐溶液会呈酸性,上网查资料发现(NH4)2SO4,FeCl3溶液呈酸性.该同学来兴趣了写出如下的学习小结,请你做一做:
(1)盐溶液pH的可能为(将你的假设填入空格中)①
(2)要测定该溶液的酸碱性用
(3)“庄稼一枝花,全靠肥当家.”(NH4)2SO4是一种氮肥能促进农作物的茎、叶生长茂盛,能使紫色石蕊试液变
(4)铵态氮肥的检测方法是:
(5)该同学加热FeCl3溶液发现有红褐色沉淀生成,请写出化学方程式:
(6)为什么Na2CO3溶液呈碱性,(NH4)2SO4,FeCl3溶液呈酸性,上网查不是很明白,是高中要学的,等上高中后我一定要搞清楚.
查看习题详情和答案>>
(1)盐溶液pH的可能为(将你的假设填入空格中)①
pH>7
pH>7
②pH<7
pH<7
③pH=7(2)要测定该溶液的酸碱性用
酸碱指示剂
酸碱指示剂
,如要知道该溶液的酸碱度可用pH试纸
pH试纸
.操作方法用玻璃棒蘸取待测液涂在pH试纸上,把显示的颜色与标准比色卡对照即可
用玻璃棒蘸取待测液涂在pH试纸上,把显示的颜色与标准比色卡对照即可
.(3)“庄稼一枝花,全靠肥当家.”(NH4)2SO4是一种氮肥能促进农作物的茎、叶生长茂盛,能使紫色石蕊试液变
红
红
色.(4)铵态氮肥的检测方法是:
与熟石灰混合研磨,观察是否有刺激性的气味产生
与熟石灰混合研磨,观察是否有刺激性的气味产生
.(5)该同学加热FeCl3溶液发现有红褐色沉淀生成,请写出化学方程式:
FeCl3+3H20
Fe(OH)3↓+3HCl
| ||
FeCl3+3H20
Fe(OH)3↓+3HCl
.(提示:Cu(OH)2等难溶性碱在pH>5盐酸中不溶解)
| ||
(6)为什么Na2CO3溶液呈碱性,(NH4)2SO4,FeCl3溶液呈酸性,上网查不是很明白,是高中要学的,等上高中后我一定要搞清楚.