摘要:氧化物中存在O2-.如:Na2O.K2O.Li2O.-属碱性氧化物.与酸反应.只能生成盐和水.如: Na2O+2HCl = 2NaCl+H2O 而过氧化物中存在O22-过氧离子.其中氧价态为-1价.如Na2O2.CaO2.-与酸反应生成盐和水.同时还有O2放出.如: 2Na2O2+4HCl = 4NaCl+2H2O+O2↑ 还有超氧化物.如:KO2.含有O2-.其中氧价态为-价.当然可能有更复杂的化合物. 应注意:过氧化物.超氧化物都不属碱性氧化物.
网址:http://m.1010jiajiao.com/timu3_id_154409[举报]
(2013?武汉模拟)工业上通常以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料制备无水氯化铝:
2Al2O3+6Cl2
4AlCl3+3O2↑.回答以下问题:
(1)画出Al的原子结构示意图
 ;Cl元素在元素周期表第
;Cl元素在元素周期表第
(2)为促进反应的进行,实际生产中需加入焦炭,其原因是
(3)加入焦炭后的化学反应可表示为Al2O3+C+Cl2
AlCl3+X↑,设计实验确定气体X的成分:
(4)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物.该反应的化学方程式为
(5)以铝土矿为原料可以通过以下途径提纯氧化铝:
①写出滤液甲中溶质的化学式
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式
查看习题详情和答案>>
2Al2O3+6Cl2
| ||
(1)画出Al的原子结构示意图


三
三
周期ⅤⅡA
ⅤⅡA
族.(2)为促进反应的进行,实际生产中需加入焦炭,其原因是
碳与O2反应,有利于反应正向进行
碳与O2反应,有利于反应正向进行
.(3)加入焦炭后的化学反应可表示为Al2O3+C+Cl2
| △ |
气体X可能为CO、CO2或两者的混合物,将生成气体依次通过澄清石灰水、灼热的CuO粉末,如溶液变浑浊,则X中存在CO2,如黑色CuO粉末变成红色粉末,则X中存在CO
气体X可能为CO、CO2或两者的混合物,将生成气体依次通过澄清石灰水、灼热的CuO粉末,如溶液变浑浊,则X中存在CO2,如黑色CuO粉末变成红色粉末,则X中存在CO
.(4)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物.该反应的化学方程式为
Al+3FeCl3=AlCl3+3FeCl2
Al+3FeCl3=AlCl3+3FeCl2
.(5)以铝土矿为原料可以通过以下途径提纯氧化铝:

①写出滤液甲中溶质的化学式
NaAlO2、Na2SiO3、NaOH
NaAlO2、Na2SiO3、NaOH
.②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
.(2012?株洲一模)已知A、B、C、D、E都是短周期主族元素,且原子序数依次增大.A、B原子的质子数之和等于C原子核内的质子数,D与B原子核外电子数之和为C原子核电荷数的两倍,D原子最外层电子数是其电子层数的3倍,A的单质是最轻的气体,E是所在周期原子半径最大的元素.请回答下列问题:
(1)E在周期表中的位置为
(2)化合物ABC是一种极弱的酸,分子中含有4个共价键,其电子式为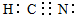
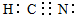 ;D、E形成的离子化合物中阴阳离子个数比为1:2,该化合物中是否存在共价键?为什么?
;D、E形成的离子化合物中阴阳离子个数比为1:2,该化合物中是否存在共价键?为什么?
(3)A、B、D、E可形成多种化合物,其中,甲、乙两种化合物的相对分子质量之比为42:41,则相同物质的量浓度的甲、乙水溶液碱性强弱顺序为:甲
(4)250C、1OlkPa下,BA4的燃烧热为a kJ/mol,9g液态水变为水蒸气吸热b kJ,则BA4燃烧生成二氧化碳和水蒸气的热化学方程式为
查看习题详情和答案>>
(1)E在周期表中的位置为
第三周期第ⅠA族
第三周期第ⅠA族
,C、D、E所形成的简单离子半径大小顺序为r(N3-)>r(O2- )>r(Na+)
r(N3-)>r(O2- )>r(Na+)
(用离子符号表示).(2)化合物ABC是一种极弱的酸,分子中含有4个共价键,其电子式为
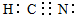
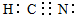
不一定存在共价键,如为Na2O2,O2-中存在共价键;如为Na2O,则不存在共价键
不一定存在共价键,如为Na2O2,O2-中存在共价键;如为Na2O,则不存在共价键
(3)A、B、D、E可形成多种化合物,其中,甲、乙两种化合物的相对分子质量之比为42:41,则相同物质的量浓度的甲、乙水溶液碱性强弱顺序为:甲
>
>
乙(填>、<或=),乙水解反应的离子方程式是CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
 CH3COOH+OH-
CH3COOH+OH-CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
. CH3COOH+OH-
CH3COOH+OH-(4)250C、1OlkPa下,BA4的燃烧热为a kJ/mol,9g液态水变为水蒸气吸热b kJ,则BA4燃烧生成二氧化碳和水蒸气的热化学方程式为
CH 4(g)+2O2(g)═CO 2(g)+2H2O(g);△H=-(a-4b)kJ/mol
CH 4(g)+2O2(g)═CO 2(g)+2H2O(g);△H=-(a-4b)kJ/mol
.(2013?和平区二模)有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每-种与D元素都能形成原子个数比不相同的若干种化合物.请回答:
(1)D元素在周期表中的位置为
(2)可以比较D和F得电子能力强弱的是
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有
 .
.
(4)已知1mol E与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如图所示.
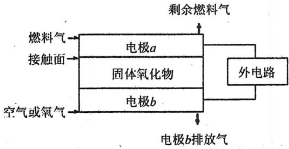
①固体氧化物中的O2-向
②电极b为电池
③若A2作为燃料气,则接触面上发生的反应为
④若B2A4作为燃料气,则接触面上发生的反应为
查看习题详情和答案>>
(1)D元素在周期表中的位置为
第二周期第VIA族
第二周期第VIA族
.(2)可以比较D和F得电子能力强弱的是
bc
bc
(填写编号).a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有
离子键、共价键
离子键、共价键
;并写出其中阳离子的电子式

(4)已知1mol E与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
2Na(s)+2H2O(l)=H2(g)↑+2NaOH(aq)△H=-567kJ/mol
2Na(s)+2H2O(l)=H2(g)↑+2NaOH(aq)△H=-567kJ/mol
.(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如图所示.

①固体氧化物中的O2-向
负
负
(填“正”或“负”)极移动.②电极b为电池
正
正
极,其电极反应式为O2+4e-=2O2-
O2+4e-=2O2-
.③若A2作为燃料气,则接触面上发生的反应为
H2+O2--2e-=H2O
H2+O2--2e-=H2O
.④若B2A4作为燃料气,则接触面上发生的反应为
C2H4+6O2--12e-=2CO2+2H2O
C2H4+6O2--12e-=2CO2+2H2O
.有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每—种与D元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)D元素在周期表中的位置为______________。
(2)可以比较D和F得电子能力强弱的是___________________(填写编号)。
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有______________________;并写出其中阳离子的电子式_________________。
(4)已知1molE与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
________________________________________________________________。
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如下图所示。

①固体氧化物中的O2-向_________(填“正”或“负”)极移动。
②电极b为电池_________极,其电极反应式为______________________________。
③若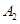 作为燃料气,则接触面上发生的反应为______________________________。
作为燃料气,则接触面上发生的反应为______________________________。
④若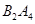 作为燃料气,则接触面上发生的反应为________________________________。
作为燃料气,则接触面上发生的反应为________________________________。
查看习题详情和答案>>
有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每-种与D元素都能形成原子个数比不相同的若干种化合物.请回答:
(1)D元素在周期表中的位置为______.
(2)可以比较D和F得电子能力强弱的是______(填写编号).
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有______;并写出其中阳离子的电子式______.
(4)已知1mol E与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式______.
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如图所示.

①固体氧化物中的O2-向______(填“正”或“负”)极移动.
②电极b为电池______极,其电极反应式为______.
③若A2作为燃料气,则接触面上发生的反应为______.
④若B2A4作为燃料气,则接触面上发生的反应为______.
查看习题详情和答案>>
(1)D元素在周期表中的位置为______.
(2)可以比较D和F得电子能力强弱的是______(填写编号).
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有______;并写出其中阳离子的电子式______.
(4)已知1mol E与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式______.
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如图所示.

①固体氧化物中的O2-向______(填“正”或“负”)极移动.
②电极b为电池______极,其电极反应式为______.
③若A2作为燃料气,则接触面上发生的反应为______.
④若B2A4作为燃料气,则接触面上发生的反应为______.
查看习题详情和答案>>