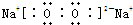题目内容
有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每—种与D元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)D元素在周期表中的位置为______________。
(2)可以比较D和F得电子能力强弱的是___________________(填写编号)。
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有______________________;并写出其中阳离子的电子式_________________。
(4)已知1molE与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
________________________________________________________________。
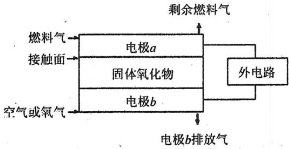
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如下图所示。
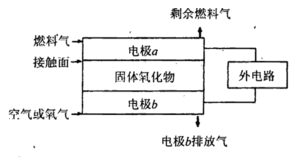
①固体氧化物中的O2-向_________(填“正”或“负”)极移动。
②电极b为电池_________极,其电极反应式为______________________________。
③若 作为燃料气,则接触面上发生的反应为______________________________。
作为燃料气,则接触面上发生的反应为______________________________。
④若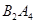 作为燃料气,则接触面上发生的反应为________________________________。
作为燃料气,则接触面上发生的反应为________________________________。
(1)第二周期第ⅥA族(1分)
(2)bc(1分)
(3)离子键、共价键;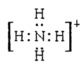 (各1分)
(各1分)
(4)2Na+2H2O=2NaOH+H2 △H=―567kJ·mol―1(2分)
(5)①负(1分)②正(1分)O2+4 e―=4O2― (2分)
③H2+O2――2 e―=2H2O(2分)④C2H4+6O2――12 e―=2CO2+2H2O(2分)
【解析】
试题分析:有原子序数依次增大的A、B、C、D、E、F六种短周期元素,A元素的原子半径是所有元素中原子最小的,所以A为H元素;C元素的最高价氧化物对应水化物与其氢化物能生成盐M,则C是N元素;E与A同主族,且与E同周期,E的原子序数大于C,所以E为Na元素;F元素原子的最外层电子数比次外层电子数少2,则F为S元素;A、B、C、E、F这五种元素,每-种与D元素都能形成原子个数比不相同的若干种化合物,则D为O元素,B为C元素,
(1)通过以上分析知,D是O元素,O元素位于第二周期第VIA族,答案为:第二周期第VIA族;
(2)比较D和F得电子能力强弱实际上就是比较两种元素的非金属性强弱,比较非金属性强弱的方法有:比较与氢气化合的难易程度、比较氢化物的稳定性、比较两种元素形成的化合物中的化合价、电负性等,故选bc;
(3)硝酸铵中 铵根离子和硝酸根离子之间存在离子键,铵根离子中氮原子和氢原子、硝酸根离子中氮原子和氧原子之间都存在共价键,铵根离子的电子式为: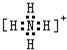 ,答案为:离子键、共价键;
,答案为:离子键、共价键;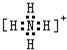 ;
;
(4)1molNa与水反应放出283.5kJ的热量,则2molNa与水反应放出567kJ热量,所以其热化学反应方程式为
2Na(s)+2H2O(l)=H2(g)↑+2NaOH(aq)△H=-567kJ·mol-1,
答案为:2Na(s)+2H2O(l)=H2(g)↑+2NaOH(aq)△H=-567kJ·mol-1;
(5)①原电池放电时阴离子向负极移动,所以O2-向负极移动,答案为:负;
②燃料电池中,正极上投放氧化剂,所以b电极是正极,正极上氧气得电子生成氧离子,所以电极反应式为O2+4e-=2O2-,故答案为:O2+4e-=2O2-;
③如果氢气为燃料,则该电极上氢气失电子和氧离子反应生成水,则电极反应式为H2+O2--2e-=H2O,答案为:H2+O2--2e-=H2O;
④如果C2H4作为燃料气,该电极上燃料失电子和氧离子反应生成二氧化碳和水,所以电极反应式为C2H4+6O2--12e-=2CO2+2H2O,
答案为:C2H4+6O2--12e-=2CO2+2H2O.
考点:位置结构性质的相互关系应用;化学电源新型电池

 阅读快车系列答案
阅读快车系列答案

 有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
有原子序数依次增大的4种短周期元素X、Y、Z、W,已知: