摘要:14.7gCaCl2的结晶水合物CaCl2·xH2O失去全部结晶水后.质量变为11.1g.通过计算可知x值为( ) A.1 B.2 C.3 D.4
网址:http://m.1010jiajiao.com/timu3_id_154358[举报]
李同学在探究铁生锈的条件时,将铁钉浸没在试管里的食盐水中,一段时间后,发现试管底部出现了黑色粉末.李同学对此黑色粉末的组成做了如下几种猜测:①Fe;②Fe2O3;③Fe3O4;④FeCl3;⑤数种物质的混合物.
请回答下列问题:
(1)你认为李同学的上述猜测中,不做实验就可以排除的是
(2)设计一个实验方案,用化学方法验证黑色粉末是否为Fe粉:
(3)李同学将黑色粉末干燥后,用磁铁靠近,发现粉末能被磁铁吸引,于是得出结论:黑色粉末一定是Fe粉,你认为李同学的结论对吗?
查看习题详情和答案>>
请回答下列问题:
(1)你认为李同学的上述猜测中,不做实验就可以排除的是
②
②
和④
④
(填序号),理由是Fe2O3是红棕色的,FeCl3可溶于水
Fe2O3是红棕色的,FeCl3可溶于水
.(2)设计一个实验方案,用化学方法验证黑色粉末是否为Fe粉:
取少量黑色粉末与稀盐酸反应,观察有无气体放出
取少量黑色粉末与稀盐酸反应,观察有无气体放出
;(3)李同学将黑色粉末干燥后,用磁铁靠近,发现粉末能被磁铁吸引,于是得出结论:黑色粉末一定是Fe粉,你认为李同学的结论对吗?
不对
不对
,理由是四氧化三铁也能被磁铁吸引
四氧化三铁也能被磁铁吸引
.(2009?三明一模)氯化亚铜(CuCl)在石油工业生产中常用作脱硫剂和脱色剂.工业生产氯化亚铜的一种工艺流程如图所示: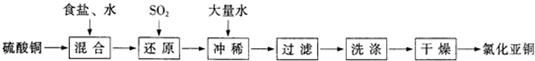
已知:①CuCl难溶于水和乙醇,干燥的CuCl在空气中比较稳定,但湿的CuCl在空气中易发生水解和氧化;②CuCl溶于氯化钠的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释可生成CuCl沉淀,反应式为CuCl2-
CuCl↓+Cl-.
(1)往CuSO4和NaCl混合液中通入SO2可生成CuCl2-和硫酸,请写出反应的离子方程式:
(2)在反应(1)中,温度升至70~80℃,并使用NaCl浓溶液,主要目的是
(3)在反应(1)中,还原剂除了可用SO2外,还可选用
A.Na2SO3 B.Cu C.Ag
(4)过滤所得沉淀须迅速用
(5)合成氨工业生产中的CO会使催化剂中毒,可通过下列反应除去.
[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)=[Cu(NH3)3]Ac?CO(aq)△H<0,生产中为了提高CO的吸收率,可采用的措施是
(6)CuOH不稳定易分解为Cu2O 298K时,CuOH的Ksp=1.0×10-14,CuCl的Ksp=1.2×10-6.把CuCl固体和NaOH溶液混合,加热,得到红色沉淀,该沉淀的化学式为
查看习题详情和答案>>

已知:①CuCl难溶于水和乙醇,干燥的CuCl在空气中比较稳定,但湿的CuCl在空气中易发生水解和氧化;②CuCl溶于氯化钠的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释可生成CuCl沉淀,反应式为CuCl2-
| H2O |
(1)往CuSO4和NaCl混合液中通入SO2可生成CuCl2-和硫酸,请写出反应的离子方程式:
2Cu2++SO2+4Cl-+2H2O=2CuCl2-+SO42-+4H+
2Cu2++SO2+4Cl-+2H2O=2CuCl2-+SO42-+4H+
.(2)在反应(1)中,温度升至70~80℃,并使用NaCl浓溶液,主要目的是
提高CuCl2-的生成速率
提高CuCl2-的生成速率
.(3)在反应(1)中,还原剂除了可用SO2外,还可选用
AB
AB
(填标号).A.Na2SO3 B.Cu C.Ag
(4)过滤所得沉淀须迅速用
95%乙醇
95%乙醇
(填“水”或“95%乙醇”)洗涤、干燥得CuCl成品.(5)合成氨工业生产中的CO会使催化剂中毒,可通过下列反应除去.
[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)=[Cu(NH3)3]Ac?CO(aq)△H<0,生产中为了提高CO的吸收率,可采用的措施是
加压降温
加压降温
.(6)CuOH不稳定易分解为Cu2O 298K时,CuOH的Ksp=1.0×10-14,CuCl的Ksp=1.2×10-6.把CuCl固体和NaOH溶液混合,加热,得到红色沉淀,该沉淀的化学式为
Cu2O
Cu2O
.[化学-物质结构与性质]
研究物质结构是为更好的掌握物质的性质.
(1)第四周期过渡元素在性质上存在一些特殊性,在前沿科技中应用广泛.
①铜为第四周期过渡元素,其基态原子电子排布式为
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
③在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有
(2)已知:下表是14种元素的电负性的数值(用X表示).
①经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键,如NaCl;当小于1.7时,一般为共价键,如AlCl3.请写出铁元素和表中非金属元素形成的常见共价化合物:
②气态氯化铝通常以二聚分子形式存在,分子式为Al2Cl6,分子中所有原子均达到8电子稳定结构,则Al2Cl6的结构式为
 .
.
③由表中两种元素形成的化合物中,分子中既含有σ键又含有π键,且二者数目相同的有(写一个即可)
查看习题详情和答案>>
研究物质结构是为更好的掌握物质的性质.
(1)第四周期过渡元素在性质上存在一些特殊性,在前沿科技中应用广泛.
①铜为第四周期过渡元素,其基态原子电子排布式为
[Ar]3d104s1
[Ar]3d104s1
,请解释金属铜能导电的原因铜是由自由电子和金属阳离子通过金属键形成,自由电子在外电场中可以定向移动,所以能导电.
铜是由自由电子和金属阳离子通过金属键形成,自由电子在外电场中可以定向移动,所以能导电.
.②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列
bc
bc
.a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
③在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有
离子键、配位键
离子键、配位键
.(2)已知:下表是14种元素的电负性的数值(用X表示).
| 元素 | Al | B | Be | C | Cl | F | Li |
| X | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | Fe |
| X | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | 1.8 |
FeCl3或FeS
FeCl3或FeS
.②气态氯化铝通常以二聚分子形式存在,分子式为Al2Cl6,分子中所有原子均达到8电子稳定结构,则Al2Cl6的结构式为


③由表中两种元素形成的化合物中,分子中既含有σ键又含有π键,且二者数目相同的有(写一个即可)
CO2或CS2
CO2或CS2
,其分子空间构型为直线型
直线型
.非诺贝特是一种常用降血酯的药物,其合成路线如图所示(无关产物均略去).
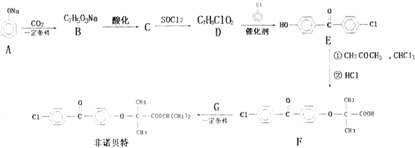
根据上述路线回答下列问题:
(1)写出指定物质的结构简式:B ,G ;
(2)D生成E的反应类型为 ; F+G→非诺贝特的反应中,无机产物的电子式为 .
(3)写出D→E的化学方程式 .
(4)下列关于非诺贝特说法中正确的是: (填序号).
①遇FeCl3,溶液显紫色;
②可发生取代、加成、消去等反应;
③1mol非诺贝特最多 能与7molH2发生加成反应;
④1mol非诺贝特最多能与2mol NaOH反应:
⑤在铜丝 上灼烧,火焰呈绿色
(5)C有多种同分异构体,同时满足下列条件的结构有 种,写出其中一种的结 构简式 .
①属于芳香族化合物;②能发生银镜反应?.③苯环上的一氯代物有两种.
查看习题详情和答案>>

根据上述路线回答下列问题:
(1)写出指定物质的结构简式:B
(2)D生成E的反应类型为
(3)写出D→E的化学方程式
(4)下列关于非诺贝特说法中正确的是:
①遇FeCl3,溶液显紫色;
②可发生取代、加成、消去等反应;
③1mol非诺贝特最多 能与7molH2发生加成反应;
④1mol非诺贝特最多能与2mol NaOH反应:
⑤在铜丝 上灼烧,火焰呈绿色
(5)C有多种同分异构体,同时满足下列条件的结构有
①属于芳香族化合物;②能发生银镜反应?.③苯环上的一氯代物有两种.