摘要:氯水中存在的微粒是( ) A.Cl2.H2O B.Cl2.H2O.Cl- C.Cl2.HCl.HClO.H2O D.Cl2.H2O.HClO.H+.Cl-.ClO-.OH-
网址:http://m.1010jiajiao.com/timu3_id_154356[举报]
|
新制氯水中存在的微粒是 | |
A. |
Cl2、HClO |
B. |
ClO-、Cl-、Cl2 |
C. |
Cl2、Cl-、H+、ClO-、H2O和极少量OH- |
D. |
Cl2、Cl-、H+、HClO、ClO-、H2O和极少量OH- |
|
新制氯水中存在的微粒是 | |
| [ ] | |
A. |
Cl2、HClO、HCl、H2O |
B. |
Cl、Cl-、Cl2、H2O |
C. |
Cl2、HCl、H2O、Cl-、H+、ClO-和极少量OH- |
D. |
Cl2、HClO、H2O、Cl-、H+、ClO-和极少量OH- |
某兴趣小组利用如下图装置探究Cl2的性质.
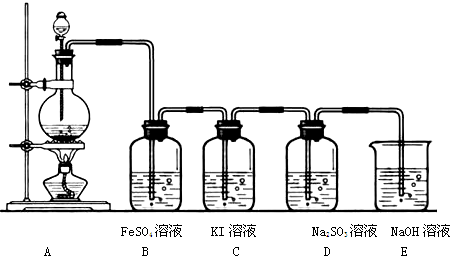
回答下列问题:
(1)A装置制取氯气时,在烧瓶里加入一定量的漂白粉,通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在A与B之间安装盛有 (填写下列编号字母)的净化装置.
A、碱石灰 B、饱和食盐水 C、浓硫酸 D、饱和碳酸氢钠溶液
(2)B溶液发生反应的离子方程式
(3)D中SO32-被Cl2氧化生成的微粒是
(A)SO42- B、S C、SO2 D、H2SO4
(4)C中现象是无色溶液变成棕黄色后又褪色.这是因为发生如下2个反应:
① ;②I2+Cl2+H2O═HIO3+ (不必配平).
(5)E中NaOH的作用是 .为证明E溶液中存在ClO-,取少量E中溶液放入试管中,滴加稀H2SO4至溶液呈酸性,再加入淀粉KI溶液,预期现象和结论是 .
查看习题详情和答案>>

回答下列问题:
(1)A装置制取氯气时,在烧瓶里加入一定量的漂白粉,通过
A、碱石灰 B、饱和食盐水 C、浓硫酸 D、饱和碳酸氢钠溶液
(2)B溶液发生反应的离子方程式
(3)D中SO32-被Cl2氧化生成的微粒是
(A)SO42- B、S C、SO2 D、H2SO4
(4)C中现象是无色溶液变成棕黄色后又褪色.这是因为发生如下2个反应:
①
(5)E中NaOH的作用是
(1)氯气与水反应(Cl2+H2O?HCl+HClO).该反应中氧化剂是______(填化学式),若氯水放置数天后其pH将______(填“变大”、“变小”或“不变”).
(2)铁是人类较早使用的金属之一.运用铁的有关知识,回答下列各题.
①据有关报道目前已能冶炼出纯度高达99.999%的铁,下列关于纯铁的叙述中正确的是______(双选)
A.能与氢氧化钠溶液反应B.能与盐酸反应
C.与不锈钢成分相同D.在冷的浓硫酸中钝化
②向沸水中逐滴滴加饱和的FeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒直径的范围是______.
③电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板Cu+2Fe3+=Cu2++2Fe2+.检验反应后的溶液中是否存在Fe3+的试剂是______.
(3)硅是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用.光导纤维让人们的生活更加丰富精彩,______是制备光导纤维的基本原料.硅燃烧放出大量热量Si+O2
SiO2,“硅能源”有望成为二十一世纪的新能源.与“传统能源”比较“硅能源”具有______、______等更加优越的特点(写出两点),从而得到全球的关注和期待.
查看习题详情和答案>>
(2)铁是人类较早使用的金属之一.运用铁的有关知识,回答下列各题.
①据有关报道目前已能冶炼出纯度高达99.999%的铁,下列关于纯铁的叙述中正确的是______(双选)
A.能与氢氧化钠溶液反应B.能与盐酸反应
C.与不锈钢成分相同D.在冷的浓硫酸中钝化
②向沸水中逐滴滴加饱和的FeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒直径的范围是______.
③电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板Cu+2Fe3+=Cu2++2Fe2+.检验反应后的溶液中是否存在Fe3+的试剂是______.
(3)硅是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用.光导纤维让人们的生活更加丰富精彩,______是制备光导纤维的基本原料.硅燃烧放出大量热量Si+O2
| ||