题目内容
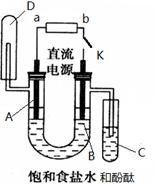
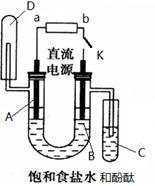
某兴趣小组利用如下图装置探究Cl2的性质.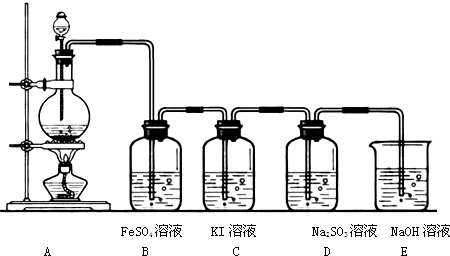
回答下列问题:
(1)A装置制取氯气时,在烧瓶里加入一定量的漂白粉,通过
A、碱石灰 B、饱和食盐水 C、浓硫酸 D、饱和碳酸氢钠溶液
(2)B溶液发生反应的离子方程式
(3)D中SO32-被Cl2氧化生成的微粒是
(A)SO42- B、S C、SO2 D、H2SO4
(4)C中现象是无色溶液变成棕黄色后又褪色.这是因为发生如下2个反应:
①
(5)E中NaOH的作用是
分析:(1)实验室制备氯气用浓盐酸和二氧化锰在加热条件反应,所用反应仪器为分液漏斗和圆底烧瓶,可用饱和食盐水除杂;
(2)装置B中亚铁离子被氯气氧化成铁离子,据此写出反应的离子方程式;
(3)氯气具有强氧化性,能够将亚硫酸根离子氧化成硫酸根离子;
(4)氯气具有强氧化性,先将碘离子氧化成碘单质,然后能够将碘单质氧化成碘酸根离子;
(5)氯气有毒,能够污染大气,所以剩余的氯气需要用氢氧化钠溶液吸收;次氯酸具有具有强氧化性,能够将碘离子氧化成碘单质,溶液变成蓝色.
(2)装置B中亚铁离子被氯气氧化成铁离子,据此写出反应的离子方程式;
(3)氯气具有强氧化性,能够将亚硫酸根离子氧化成硫酸根离子;
(4)氯气具有强氧化性,先将碘离子氧化成碘单质,然后能够将碘单质氧化成碘酸根离子;
(5)氯气有毒,能够污染大气,所以剩余的氯气需要用氢氧化钠溶液吸收;次氯酸具有具有强氧化性,能够将碘离子氧化成碘单质,溶液变成蓝色.
解答:解:(1)实验室制备氯气用浓盐酸和二氧化锰在加热条件反应,所用反应仪器为分液漏斗和圆底烧瓶,生成氯气混有HCl气体,根据氯气难溶于饱和氯化钠溶液,HCl易溶于水,可用饱和食盐水除杂,
故答案为:分液漏斗;B;
(2)硫酸亚铁溶液中亚铁离子具有还原性,能够与氯气反应,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)装置D中亚硫酸根离子具有还原性,能够被氯气氧化成SO42-,
故答案为:A;
(4)C在为碘化钾溶液,碘离子具有还原性,能够被氯气氧化成碘单质,所以溶液显示棕黄色,反应的化学方程式为:2KI+Cl2=I2+KCl;氯气还能够将碘单质氧化成碘酸根离子,溶液颜色褪去,根据质量守恒定律可知另一种反应产物为HCl,
故答案为:2KI+Cl2=I2+KCl;HCl;
(5)氯气有毒,会对氮气造成污染,所以多余的氯气需要进行吸收,装置E用于吸收氯气;为了证明E溶液中存在ClO-,取少量E中溶液放入试管中,滴加稀H2SO4至溶液呈酸性,再加入淀粉KI溶液,由于次氯酸具有强氧化性,将碘离子氧化成碘单质,所以淀粉碘化钾溶液显示蓝色,
故答案为:吸收尾气;溶液变为蓝色,证明存在ClO-.
故答案为:分液漏斗;B;
(2)硫酸亚铁溶液中亚铁离子具有还原性,能够与氯气反应,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)装置D中亚硫酸根离子具有还原性,能够被氯气氧化成SO42-,
故答案为:A;
(4)C在为碘化钾溶液,碘离子具有还原性,能够被氯气氧化成碘单质,所以溶液显示棕黄色,反应的化学方程式为:2KI+Cl2=I2+KCl;氯气还能够将碘单质氧化成碘酸根离子,溶液颜色褪去,根据质量守恒定律可知另一种反应产物为HCl,
故答案为:2KI+Cl2=I2+KCl;HCl;
(5)氯气有毒,会对氮气造成污染,所以多余的氯气需要进行吸收,装置E用于吸收氯气;为了证明E溶液中存在ClO-,取少量E中溶液放入试管中,滴加稀H2SO4至溶液呈酸性,再加入淀粉KI溶液,由于次氯酸具有强氧化性,将碘离子氧化成碘单质,所以淀粉碘化钾溶液显示蓝色,
故答案为:吸收尾气;溶液变为蓝色,证明存在ClO-.
点评:本题考查了考查了氯气的实验室制法、性质实验方案的设计,题目难度中等,注意掌握氯气性质及氯气实验室制法,掌握性质实验方案设计的原则.

练习册系列答案
相关题目