摘要:将50.7g碳酸钠.硫酸钠.氯化钠混合物分成两个等份.一份加入足量的盐酸.产生气体在标准状况下的的体积为1.12L.另一份加入足量的氯化钡溶液.过滤.得难溶性固体33.15g.计算原混合物中碳酸钠.硫酸钠.氯化钠物质的量
网址:http://m.1010jiajiao.com/timu3_id_154168[举报]
在给定条件下,下列划线物质在化学反应中能被完全消耗的是( )
| A、用40 ml 10mol/L浓盐酸与8.7g 二氧化锰共热制取氯气 | B、标况下,将2.7g 铝片投入到20 ml 18 mol/L的浓硫酸中 | C、向120 ml 2 mol/L 的盐酸中加入5.6g 铁 | D、向Ba(OH)2和NaOH各0.1mol的混合溶液中通入标准状况下2.24L CO2 气体 |
已知:①2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1.下列说法中错误的是( )
查看习题详情和答案>>
下列各组溶液,不用其它试剂,就可以将它们区别开的是( )
| A、盐酸、氢氧化钠、碳酸钠、硫酸钠 | B、盐酸、硝酸银、氢氧化钠、硝酸钠 | C、氢氧化钠、硫酸镁、碳酸钠、硫酸氢钠 | D、氯化钡、硫酸钠、氯化钙、硝酸钙 |
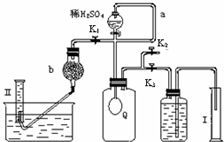 过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用.
过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用.已知:过碳酸钠与硫酸溶液反应的化学方程式如下:
Na2CO4+H2SO4→Na2SO4+H2O2+CO2↑ 2H2O2→2H2O+O2↑为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为-具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中.
(1)Q内发生反应生成的气体为
CO2、O2
CO2、O2
.导管a作用是平衡分液漏斗上、下的压强,使稀H2SO4顺利滴下
平衡分液漏斗上、下的压强,使稀H2SO4顺利滴下
.(2)为测出反应时生成气体的总体积,滴稀H2SO4前必须关闭K1、K2,打开K3.当上述反应停止,将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是
气球Q慢慢缩小,左侧导管有气泡生成
气球Q慢慢缩小,左侧导管有气泡生成
,b中装的碱石灰的作用是吸收二氧化碳
吸收二氧化碳
.(3)实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到ymL气体(上述体积均已折算到标准状况),则过碳酸钠的纯度是
| 12200y |
| 53x+69y |
| 12200y |
| 53x+69y |
(4)某同学实验测得的过碳酸钠的纯度超过100%,你认为可能的原因是
BC
BC
A.气体滞留在Q和导气管中,未全部进入量筒Ⅱ
B.量筒Ⅱ读数时,量筒液面高于水槽液面
C.右侧量筒Ⅰ和储液集气瓶连接导管内的液体没有计入读数x
D.气体体积数值x、y没有扣除滴加的硫酸的体积.