摘要:下列结论正确的是: ( ) (1)粒子半径:S2->Cl > S >F (2)稳定性:HF>HCl>H2S>H2Te (3)还原性:S2->Cl->Br->I- (4)氧化性:Cl2>S>Se>Te (5)酸性:H2SO4>HClO4>H2SO3 (6)非金属性:F>Cl>S>Se A. D.
网址:http://m.1010jiajiao.com/timu3_id_153940[举报]
下列结论正确的是
①微粒半径: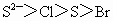 ②氢化物的稳定性:
②氢化物的稳定性: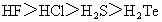 ③离子的还原性:
③离子的还原性: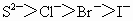 ④氧化性:
④氧化性: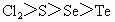 ⑤最高价含氧酸酸性:
⑤最高价含氧酸酸性: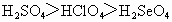 ⑥非金属性:F>Cl>S>Se
⑥非金属性:F>Cl>S>Se
[ ]
A.②④⑥
B.①③④
C.①
D.⑥
下列结论正确的是
①微粒半径: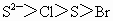 ②氢化物的稳定性:
②氢化物的稳定性: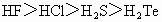 ③离子的还原性:
③离子的还原性: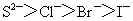 ④氧化性:
④氧化性: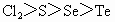 ⑤最高价含氧酸酸性:
⑤最高价含氧酸酸性: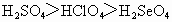 ⑥非金属性:F>Cl>S>Se
⑥非金属性:F>Cl>S>Se
[ ]
A.②④⑥
B.①③④
C.①
D.⑥
已知反应:下列结论正确的是( )
①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4.
①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4.
查看习题详情和答案>>
固体碘化铵置于密闭容器中,加热至一定温度后恒温;容器中发生反应:
①NH4I(s)?NH3(g)+HI(g)
②2HI(g)?H2(g)+I2(g),测得平衡时c(H2)=0.5mol/L,反应①的平衡常数为20,
则下列结论正确的是( )
①NH4I(s)?NH3(g)+HI(g)
②2HI(g)?H2(g)+I2(g),测得平衡时c(H2)=0.5mol/L,反应①的平衡常数为20,
则下列结论正确的是( )
| A、固体碘化铵一定完全分解 | B、当固体碘化铵物质的量增大一倍,则在相同条件下,容器内压强也增大一倍 | C、平衡时HI分解率为40% | D、平衡时C(NH3)=5mol/L |
实验室有一瓶久置的白色K2SO3粉末,为确定其是否被氧化及其成分,元素分析表明粉末中K和S元素的质量比为39:16,下列结论正确的是( )
| A、根据元素分析结果推测该粉末为纯净物 | B、将粉末溶于水,加入氯化钡,有白色沉淀生成,证明原粉末是K2SO4 | C、将粉末加入盐酸中,产生气泡,证明原粉末是K2SO3 | D、将粉末溶于水,加入氯化钡和过量的盐酸,有白色沉淀和气泡生成,证明原粉末是K2SO4和K2SO3的混合物 |