摘要:(一)配制一定物质的量浓度的硬脂酸的苯溶液(硬脂酸是一种不溶于水的有机弱酸.苯是一种易挥发的有机溶剂)
网址:http://m.1010jiajiao.com/timu3_id_153905[举报]
在众多的化学反应现象中,化学振荡现象最为令人惊奇,化学振荡实验很多,其中酸与铁丝的反应就是其中一例.某合作小组的同学查阅文献资料后,拟做铁丝与酸的化学振荡实验并进行探究.
实验步骤:
①将2cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净.
②在细口瓶中加入30mL1.0mol/L的H3PO4、3mL30%的H2O2溶液,将处理后的铁丝放入其中.
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时.
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是 (选填序号:A.NaOH B.盐酸C.酒精).
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证.
甲同学认为是H2,其可能的理由是: .
乙同学认为是O2,其可能的理由是: .
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是 .
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a) Fe+2H+→Fe2++H2 (b)2Fe2++H2O2+H2O→Fe2O3+4H+
(c)Fe2O3+6H+→2Fe3++3H2O (d)2Fe3++H2→2Fe2++2H+,依据过程:
(a)→(b)→(c)→(d)→(a)…周而复始.
依据此机理,四步反应总的反应方程式为: .
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
所配硫酸的物质的量浓度为: mol/L;铁钉中单质铁的质量分数为 .
查看习题详情和答案>>
实验步骤:
①将2cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净.
②在细口瓶中加入30mL1.0mol/L的H3PO4、3mL30%的H2O2溶液,将处理后的铁丝放入其中.
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时.
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证.
甲同学认为是H2,其可能的理由是:
乙同学认为是O2,其可能的理由是:
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a) Fe+2H+→Fe2++H2 (b)2Fe2++H2O2+H2O→Fe2O3+4H+
(c)Fe2O3+6H+→2Fe3++3H2O (d)2Fe3++H2→2Fe2++2H+,依据过程:
(a)→(b)→(c)→(d)→(a)…周而复始.
依据此机理,四步反应总的反应方程式为:
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
| ① | ② | ③ | |
| 硫酸溶液体积/mL | 50 | 50 | 50 |
| 称取铁钉质量/g | 5.0 | 6.0 | 7.0 |
| 再投入铜粉质量/g | 1.0 | 1.0 | 1.0 |
| 标准状况下的体积/L | 1.97 | 2.24 | 2.24 |
有关化学实验的基本操作中,正确的是( )
①配制240mL一定物质的量浓度的溶液,用250mL的容量瓶
②金属钠不能保存在液态石蜡中
③测定某溶液的pH,步骤是将干燥的试纸浸入待测溶液中,过一会儿取出,并与标准比色卡比较
④中和热测定实验中以环形铜丝搅拌棒代替环形玻璃搅拌棒会使测定值比理论值偏低
⑤浓NaOH溶液溅到皮肤上,应立即用稀硫酸清洗
⑥称量时,将硫酸铜晶体直接放在天平右盘上进行称量
⑦将烧杯、试管直接放在酒精灯上加热.
①配制240mL一定物质的量浓度的溶液,用250mL的容量瓶
②金属钠不能保存在液态石蜡中
③测定某溶液的pH,步骤是将干燥的试纸浸入待测溶液中,过一会儿取出,并与标准比色卡比较
④中和热测定实验中以环形铜丝搅拌棒代替环形玻璃搅拌棒会使测定值比理论值偏低
⑤浓NaOH溶液溅到皮肤上,应立即用稀硫酸清洗
⑥称量时,将硫酸铜晶体直接放在天平右盘上进行称量
⑦将烧杯、试管直接放在酒精灯上加热.
| A、①②③⑥ | B、①④ | C、②③④⑥ | D、③⑤⑥⑦ |
下列仪器:①烧杯②蒸馏烧瓶 ③容量瓶④普通漏斗⑤分液漏斗⑥蒸发皿⑦玻璃棒⑧铁架台(带铁圈、铁夹)⑨酒精灯⑩温度计,在蒸馏时需要用到的有
查看习题详情和答案>>
②⑧⑨⑩
②⑧⑨⑩
(填仪器的标号,下同);在萃取时需用到的有①⑤⑧
①⑤⑧
;在配制一定物质的量浓度的溶液时需用到的有①③⑦
①③⑦
.
铁是人类必需的微量元素之一,它可以促进血红蛋白结合氧分子进行输氧,医学上经常用硫酸亚铁糖衣片给患贫血的病人补铁.请根据以下药品说明书回答问题:

(1)药片上的糖衣可以起 的作用,鉴定时溶解加盐酸的目的是 .
(2)某研究小组甲欲用KMnO4测定FeSO4的含量.
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250毫升,配制时需要的仪器除托盘天平、烧杯、玻璃棒、量筒外,还需要的仪器有 、 .
②滴定时含硫酸亚铁的滤液放在 (填仪器)中,高锰酸钾溶液放在 (填仪器)中,滴定时加入 (填“酚酞”或“甲基橙”或“石蕊”或“不用加”)指示剂,如何判断达到滴定终点 .
(3)另一研究小组乙设计了如下测量方案:
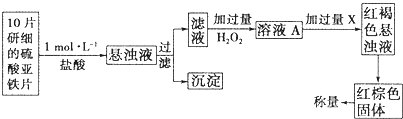
①此检验过程中加过量H2O2反应的离子方程式为 .
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有 (按操作的顺序填写).
A.过滤 B.洗涤 C.萃取 D.分液 E.冷却 F.灼烧
③最后称量红棕色固体的质量为0.8960g,那么该药片中硫酸亚铁的质量分数为 (小数点后面保留一位有效数字).
查看习题详情和答案>>

(1)药片上的糖衣可以起
(2)某研究小组甲欲用KMnO4测定FeSO4的含量.
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250毫升,配制时需要的仪器除托盘天平、烧杯、玻璃棒、量筒外,还需要的仪器有
②滴定时含硫酸亚铁的滤液放在
(3)另一研究小组乙设计了如下测量方案:

①此检验过程中加过量H2O2反应的离子方程式为
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有
A.过滤 B.洗涤 C.萃取 D.分液 E.冷却 F.灼烧
③最后称量红棕色固体的质量为0.8960g,那么该药片中硫酸亚铁的质量分数为
下列有关实验基本操作的说法错误的是( )
| A、存放新制氯水时,使用带玻璃塞的棕色玻璃瓶 | B、配制一定物质的量浓度的溶液时,若开始容量瓶中有少量蒸馏水,对浓度无影响 | C、酸碱中和滴定实验中用到的玻璃仪器仅有酸式滴定管、碱式滴定管和烧杯 | D、进行蒸发操作时,不能使混合物中的水分完全蒸干 |