摘要:2.3g钠在干燥的空气中被氧化后.可得3.5g固体.因此可以判断其氧化产物为( ) A.只有Na2O2 B.只有Na2O2 C.Na2O2和Na2O D.无法确定
网址:http://m.1010jiajiao.com/timu3_id_153782[举报]
 氨气是一种重要的化工原料,但随着工业化进程的加快,氨气也逐渐变成居室里一种重要的污染性气体.
氨气是一种重要的化工原料,但随着工业化进程的加快,氨气也逐渐变成居室里一种重要的污染性气体.(1)液氨和水类似,也能发生电离:NH3+NH3=NH4++NH2-,其离子积常数为l.0×l0-30.现将2.3g金属钠投入1.0L液氨中,则液氨电离平衡
正方向
正方向
移动(填“不”、“正方向”、“逆方向”);待反应结束后,假设溶液的体积不变,所得溶液中NH4+的浓度为1×10-29mol/L
1×10-29mol/L
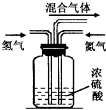
.(2)实验室模拟工业上用氮气和氢气合成氨气时,在反应前将两种气体通过如图装置,该装置的作用有三个:
①将氮气和氢气干燥:
②使氮气和氢气充分混合;
③
通过观察气泡控制氮气和氢气的流量,使氮气和氢气的量达到最佳比例
通过观察气泡控制氮气和氢气的流量,使氮气和氢气的量达到最佳比例
,从而提高氮气和氢气的利用率.(3)实验室可用氨气通过红热的氧化铜制取氮气,写出该反应的化学方程式:
2NH3+3CuO
3Cu+N2+3H2O
| ||
2NH3+3CuO
3Cu+N2+3H2O
.
| ||
(4)家庭空气中的氨主要来自建筑施工中使用的混凝土外加剂,如混凝土防冻剂尿素会和水缓慢发生反应:CO(NH2)2(s)+H2O(g) 2NH3(g)+CO2(g),该反应的平衡常数表达式为K=
| C2(NH3)?C(CO2) |
| C(H2O) |
| C2(NH3)?C(CO2) |
| C(H2O) |
(5)已知:N2(g)+O2(g)=2NO(g);△H=180Kj?mol-l4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-908Kj?mol-l请写出氨气被一氧化氮氧化生成氮气和气态水的热化学方程式:
4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1808KJ/mol
4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1808KJ/mol
.