题目内容
 氨气是一种重要的化工原料,但随着工业化进程的加快,氨气也逐渐变成居室里一种重要的污染性气体.
氨气是一种重要的化工原料,但随着工业化进程的加快,氨气也逐渐变成居室里一种重要的污染性气体.(1)液氨和水类似,也能发生电离:NH3+NH3=NH4++NH2-,其离子积常数为l.0×l0-30.现将2.3g金属钠投入1.0L液氨中,则液氨电离平衡
正方向
正方向
移动(填“不”、“正方向”、“逆方向”);待反应结束后,假设溶液的体积不变,所得溶液中NH4+的浓度为1×10-29mol/L
1×10-29mol/L
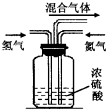
.(2)实验室模拟工业上用氮气和氢气合成氨气时,在反应前将两种气体通过如图装置,该装置的作用有三个:
①将氮气和氢气干燥:
②使氮气和氢气充分混合;
③
通过观察气泡控制氮气和氢气的流量,使氮气和氢气的量达到最佳比例
通过观察气泡控制氮气和氢气的流量,使氮气和氢气的量达到最佳比例
,从而提高氮气和氢气的利用率.(3)实验室可用氨气通过红热的氧化铜制取氮气,写出该反应的化学方程式:
2NH3+3CuO
3Cu+N2+3H2O
| ||
2NH3+3CuO
3Cu+N2+3H2O
.
| ||
(4)家庭空气中的氨主要来自建筑施工中使用的混凝土外加剂,如混凝土防冻剂尿素会和水缓慢发生反应:CO(NH2)2(s)+H2O(g) 2NH3(g)+CO2(g),该反应的平衡常数表达式为K=
| C2(NH3)?C(CO2) |
| C(H2O) |
| C2(NH3)?C(CO2) |
| C(H2O) |
(5)已知:N2(g)+O2(g)=2NO(g);△H=180Kj?mol-l4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-908Kj?mol-l请写出氨气被一氧化氮氧化生成氮气和气态水的热化学方程式:
4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1808KJ/mol
4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1808KJ/mol
.分析:(1)液氨和水类似,也能发生电离:NH3+NH3=NH4++NH2-,将2.3g金属钠投入1.0L液氨中会结合NH2-,促进液氨的电离,钠与液氨反应生成NaNH2,结合化学方程式计算;
(2)将氮气和氢气干燥,使氮气和氢气充分混合,控制氮气和氢气通入的比例和通入的快慢,提高原料的利用率;
(3)依据氧化铜做氧化剂氧化氨气生成氮气,本身被还原为铜;依据化学方程式的书写原则写出;
(4)平衡常数是用平衡时生成物的浓度幂次方乘积除以反应物的幂次方乘积;
(5)依据盖斯定律结合热化学方程式计算写出.
(2)将氮气和氢气干燥,使氮气和氢气充分混合,控制氮气和氢气通入的比例和通入的快慢,提高原料的利用率;
(3)依据氧化铜做氧化剂氧化氨气生成氮气,本身被还原为铜;依据化学方程式的书写原则写出;
(4)平衡常数是用平衡时生成物的浓度幂次方乘积除以反应物的幂次方乘积;
(5)依据盖斯定律结合热化学方程式计算写出.
解答:解:(1)将2.3g金属钠投入1.0L液氨中发生反应为:2Na+2NH3=2NaNH2+H2↑;促进液氨的电离,依据:NH3+NH3=NH4++NH2-,[NH4+][NH2-]=l.0×l0-30;反应生成NH2-物质的量为0.1mol;浓度为0.1mol/L,所得溶液中NH4+的浓度l.0×l0-29mol/L,故答案为:正方向;1.0×l0-29mol/L;
(2)该装置的作用有三个将氮气和氢气干燥,使氮气和氢气充分混合,控制氮气和氢气通入的比例和通入的快慢,提高原料的利用率,
故答案为:通过观察气泡控制氮气和氢气的流量,使氮气和氢气的量达到最佳比例;
(3)用氨气通过红热的氧化铜制取氮气,依据氧化还原反应的化合价升降相同,氧化铜中铜的元素化合价降低生成铜,反应的化学方程式为:2NH3+3CuO
3Cu+N2+3H2O,
故答案为:2NH3+3CuO
3Cu+N2+3H2O;
(4)CO(NH2)2(s)+H2O(g)?2NH3(g)+CO2(g),依据化学平衡,结合平衡常数的计算式列式:平衡常数是用平衡时生成物的浓度幂次方乘积除以反应物的幂次方乘积,得到平衡常数表达式:K=
,故答案为:
;
(5)①N2(g)+O2(g)=2NO(g);△H=180Kj?mol-l
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-908Kj?mol-l
氨气被一氧化氮氧化生成氮气和气态水的热化学方程式依据盖斯定律,结合热化学方程式合并计算:①×5+②得到:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1808KJ/mol,
故答案为:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1808KJ/mol.
(2)该装置的作用有三个将氮气和氢气干燥,使氮气和氢气充分混合,控制氮气和氢气通入的比例和通入的快慢,提高原料的利用率,
故答案为:通过观察气泡控制氮气和氢气的流量,使氮气和氢气的量达到最佳比例;
(3)用氨气通过红热的氧化铜制取氮气,依据氧化还原反应的化合价升降相同,氧化铜中铜的元素化合价降低生成铜,反应的化学方程式为:2NH3+3CuO
| ||
故答案为:2NH3+3CuO
| ||
(4)CO(NH2)2(s)+H2O(g)?2NH3(g)+CO2(g),依据化学平衡,结合平衡常数的计算式列式:平衡常数是用平衡时生成物的浓度幂次方乘积除以反应物的幂次方乘积,得到平衡常数表达式:K=
| C2(NH3)?C(CO2) |
| C(H2O) |
| C2(NH3)?C(CO2) |
| C(H2O) |
(5)①N2(g)+O2(g)=2NO(g);△H=180Kj?mol-l
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-908Kj?mol-l
氨气被一氧化氮氧化生成氮气和气态水的热化学方程式依据盖斯定律,结合热化学方程式合并计算:①×5+②得到:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1808KJ/mol,
故答案为:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1808KJ/mol.
点评:本题考查对水的离子积理解与迁移能力.由水的离子积可知,其大小只与温度有关,与溶液浓度无关;明确简单装置合成氨的工艺流程中装置的作用、平衡常数的计算应用、热化学方程式的书写原则即可解答.

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
氨气是一种重要的化工原料.下列关于氨气性质的描述不正确的是( )
| A、无色 | B、无味 | C、易液化 | D、极易溶于水 |
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
(1)实验室中常用来制备氨气的化学方程式为 .
(2)已知H2(g)的燃烧热为285.8kJ?mol-1,写出NH3(g)在纯氧中燃烧生成无毒、无害物质的热化学方程式 .
(3)25℃时,将a mol (NH4)2SO4溶于水,向该溶液中滴加V L稀氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将 (填“正向”、“不”或“逆向”)移动,所滴加稀氨水的物质的量浓度为 mol?L-1.(25℃时,NH3?H2O的电离平衡常数Kb≈2×10-5).
(4)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)
CO(NH2)2(l)+H2O(g)△H<0,t℃时,向容积恒定为2L的密闭容器中加入0.10mol CO2和0.40mol NH3,70min开始达到平衡.反应中CO2(g)的物质的量随时间变化如下表所示:
①20min时v正(CO2) 80min时v逆(H2O)(填“>”、“=”或“<”).
②在100min时,保持其它条件不变,再向容器中充入0.050mol CO2和0.20mol NH3,重新建立平衡后CO2的转化率与原平衡相比将 (填“增大”、“不变”或“减小”).
③根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象;保持其它条件不变,则(t+10)℃下正确的图象可能是 (填图甲中的“A”或“B”).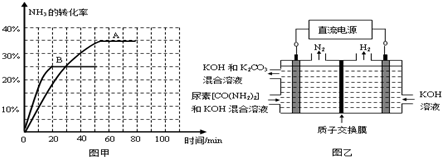
④图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素[CO(NH2)2]的碱性溶液制取氢气.该装置中阳极的电极反应式为 ,若两极共收集到气体22.4L(标况),则消耗的尿素为 g(忽略气体的溶解).
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
(1)实验室中常用来制备氨气的化学方程式为
(2)已知H2(g)的燃烧热为285.8kJ?mol-1,写出NH3(g)在纯氧中燃烧生成无毒、无害物质的热化学方程式
(3)25℃时,将a mol (NH4)2SO4溶于水,向该溶液中滴加V L稀氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将
(4)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)
| 一定条件 |
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
②在100min时,保持其它条件不变,再向容器中充入0.050mol CO2和0.20mol NH3,重新建立平衡后CO2的转化率与原平衡相比将
③根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象;保持其它条件不变,则(t+10)℃下正确的图象可能是

④图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素[CO(NH2)2]的碱性溶液制取氢气.该装置中阳极的电极反应式为
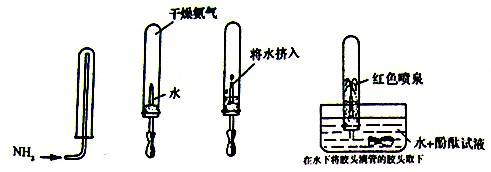
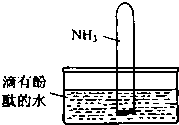 氨气是一种重要的化工原料.完成下列填空:
氨气是一种重要的化工原料.完成下列填空: