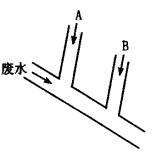
摘要:23.某工厂排出的废水含游离氯(Cl2)和H+的物质的量浓度分别为0.015mol/L和0.001mol/L.废水的排出速度为10.0mL/s.为除去游离氯.并使废水呈中性.某研究性学习小组的学生设计如图所示方案.在A.B两处分别注入物质的量浓度为0.1mol/L的NaOH溶液及0.15mol/L的Na2SO3溶液.以中和H+并还原Cl2.已知Cl2和Na2SO3溶液的反应为:Cl2+Na2SO3+H2O==Na2SO4+2HCl (1)A处注入溶液为 .B处注入溶液与废水发生反应的离子方程式为 . (2)试计算两种溶液的注入速度.写出计算过程.
网址:http://m.1010jiajiao.com/timu3_id_153747[举报]
某化工厂排出的废水含Cl2为0.014mo1·L-1、H+为0.001mo1·L-1,废水排 出的速度为10.0mL·s-1。为了除去此废水中的游离氯,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱液(0.10mo1·L-1)和Na2SO4溶液(0.10mo1·L-1)。
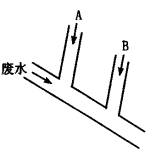
试回答:
(1)A处应注入________溶液,离子方程式为________;B处应注入________溶液,离子方程 式为_________。
(2)A处溶液的流量和B处溶液的流量分别应控制为多少(mL·s-1)?
查看习题详情和答案>>