摘要:3.2gSO2在标准状况下体积约为 L.同温同压下O2和SO2的密度之比为 ,含有相同氧原子数的O2与SO2的物质的的量之比为 .
网址:http://m.1010jiajiao.com/timu3_id_153720[举报]
用氯气对饮用水消毒已有百年历史.这种消毒方法会使饮用水中的有机物发生氯代反应,生成有机含氯化合物,对人体有害,且氯气本身也是一种有毒气体.世界环保联盟即将全面禁止用氯气对饮用水消毒,建议推广采用广谱性高效消毒剂二氧化氯(ClO2).目前欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,反应的化学方程式为:
(1)配平上述化学方程式.
(2)此反应中氧化剂是:
(3)在标准状况下有4.48L氯气生成时,转移的电子数为
(4)我国研制成功用氯气氧化亚氯酸钠(在氮气保护下)制得ClO2,表示这一反应的化学方程式是2NaClO2+Cl2═2ClO2↑+2A.已知A物质是一种盐,它的化学式为
查看习题详情和答案>>
2
2
NaClO3+4
4
HCl═2
2
NaCl+2
2
ClO2↑+1
1
Cl2↑+2
2
H2O.(1)配平上述化学方程式.
(2)此反应中氧化剂是:
NaClO3
NaClO3
,在反应中盐酸体现的性质是还原性
还原性
和酸性
酸性
;(3)在标准状况下有4.48L氯气生成时,转移的电子数为
0.4
0.4
mol,被氧化的盐酸的物质的量为0.4
0.4
mol.(4)我国研制成功用氯气氧化亚氯酸钠(在氮气保护下)制得ClO2,表示这一反应的化学方程式是2NaClO2+Cl2═2ClO2↑+2A.已知A物质是一种盐,它的化学式为
NaCl
NaCl
.这一方法的优点是不产生有毒的氯气,减小对环境的污染
不产生有毒的氯气,减小对环境的污染
.下表为周期表的一部分,其中的字母代表对应的元素
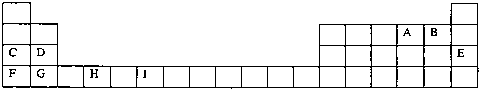
请回答下列问题:
(1)写出元素I的基态原子的价电子排布式 ;已知M2+离子3d轨道中有6个电子,试推出M元素位于周期表的 周期 族.
(2)请列举F的金属性比C强的实验事实: ,并用原子结构理论解释其原因: .
(3)在标准状况下,根据M=
测定B的气态氢化物的相对分子质量,结果发现,测定结果总比理论值高,其原因是 .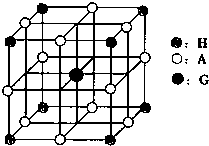
(4)H、A、G三种元素形成的晶体是一种矿物的主要成分,其晶胞结构如图,则该晶体的化学式为 ;在该晶体中,G离子的配位数为 ;若晶胞的边长为acm,则晶体的密度为 g/cm3.
查看习题详情和答案>>

请回答下列问题:
(1)写出元素I的基态原子的价电子排布式
(2)请列举F的金属性比C强的实验事实:
(3)在标准状况下,根据M=
| m | n |

(4)H、A、G三种元素形成的晶体是一种矿物的主要成分,其晶胞结构如图,则该晶体的化学式为
阿伏加德罗常数用NA表示,完成下列填空.
(1)20g 重水 (D2O)中含有
(2)1mol的12C 原子中含有
(3)在标准状况下,11.2L 氮气中约有
(4)含有8个质子,10个中子的某核素9g,则原子个数为
查看习题详情和答案>>
(1)20g 重水 (D2O)中含有
10
10
NA个电子;(2)1mol的12C 原子中含有
6
6
NA个中子;(3)在标准状况下,11.2L 氮气中约有
1
1
NA个原子;(4)含有8个质子,10个中子的某核素9g,则原子个数为
0.5
0.5
NA.(1)质量相等的两种物质SO2和SO3,两种物质中分子物质的量之比为
(2)20.6g NaR 含有Na+0.2mol,则NaR的摩尔质量为
(3)在标准状况下,4.8g甲烷(CH4)所占的体积为
(4)中和浓度为4mol/L,体积为25mLH2SO4溶液,需要NaOH的质量为
(5)已知8gA能与32gB恰好完全反应,生成22gC和一定量D,现将16gA与70gB的混合物充分反应后,生成2molD和一定量C,则D的摩尔质量为
查看习题详情和答案>>
5:4
5:4
,所含氧原子个数之比为5:6
5:6
;(2)20.6g NaR 含有Na+0.2mol,则NaR的摩尔质量为
103
103
g/mol,则含R 8.0g 的NaR的物质的量为0.1
0.1
mol;(3)在标准状况下,4.8g甲烷(CH4)所占的体积为
6.72
6.72
L,它与标准状况下13.44
13.44
L硫化氢(H2S)含有相同数目的氢原子;(4)中和浓度为4mol/L,体积为25mLH2SO4溶液,需要NaOH的质量为
8
8
g;(5)已知8gA能与32gB恰好完全反应,生成22gC和一定量D,现将16gA与70gB的混合物充分反应后,生成2molD和一定量C,则D的摩尔质量为
18
18
g/mol.