摘要:不能使橙黄色溴水变为无色溶液的是 A.KOH溶液 B.镁粉 C.CCl4 D.KI溶液
网址:http://m.1010jiajiao.com/timu3_id_153631[举报]
(2011?江西一模)【实验探究】已知稀溴水和氯化铁溶液都呈黄色.现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究.?
(1)仅限选用的仪器和试剂有:烧杯、试管、玻璃棒、量筒、滴管、药匙;酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉-碘化钾溶液.?
完成以下实验探究过程:
【提出假设】假设1:溶液呈黄色不是发生化学反应所致,是溶液中
假设2:溶液呈黄色是发生化学反应所致,是溶液中
【设计实验方案】
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:?验证假设1的方案:
(2)根据高中所学的知识判断,你认为
(3)若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为
查看习题详情和答案>>
(1)仅限选用的仪器和试剂有:烧杯、试管、玻璃棒、量筒、滴管、药匙;酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉-碘化钾溶液.?
完成以下实验探究过程:
【提出假设】假设1:溶液呈黄色不是发生化学反应所致,是溶液中
Br2
Br2
引起的(填微粒的化学式,下同).假设2:溶液呈黄色是发生化学反应所致,是溶液中
Fe3+
Fe3+
引起的.?【设计实验方案】
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:?验证假设1的方案:
向黄色溶液中加入CCl4,振荡,静置,下层溶液呈橙红色
向黄色溶液中加入CCl4,振荡,静置,下层溶液呈橙红色
,本方案所用到的主要玻璃仪器有:分液漏斗,烧杯
分液漏斗,烧杯
.?验证假设2的方案:向黄色溶液中滴加KSCN溶液,溶液变为血红色
向黄色溶液中滴加KSCN溶液,溶液变为血红色
.?(2)根据高中所学的知识判断,你认为
假设2
假设2
(填“假设1”或“假设2”)的推断是正确的;若选用淀粉-碘化钾溶液验证你的假设是否可行?不可行
不可行
(填“可行”或“不可行”),理由是因为Br2和Fe3+都能把I-氧化成I2,使溶液变蓝,无法得出结论
因为Br2和Fe3+都能把I-氧化成I2,使溶液变蓝,无法得出结论
.(3)若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为
2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
.(2013?浦东新区三模)某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).
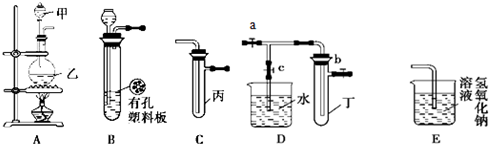
请按要求填空:?
(1)利用B装置可制取的气体有
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:?
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由.
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)
(4)B中发生反应的化学方程式为
(5)欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹
(6)试管丁中的NO2与一定量的O2混合后倒插水中,试管9/10充满水,则原试管丁中的混合气体的平均分子量可能为
查看习题详情和答案>>

请按要求填空:?
(1)利用B装置可制取的气体有
H2、CO2、H2S等
H2、CO2、H2S等
(填2种).(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:?
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
不合理,没有事先证明干燥的氯气无漂白性;不合理;制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡
不合理,没有事先证明干燥的氯气无漂白性;不合理;制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡
.(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)
在甲、乙、丙中分别装入浓盐酸、二氧化锰、溴化钠溶液;烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,可证明氯气的氧化性强于溴
在甲、乙、丙中分别装入浓盐酸、二氧化锰、溴化钠溶液;烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,可证明氯气的氧化性强于溴
.B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.(4)B中发生反应的化学方程式为
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
.(5)欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹
a、b
a、b
,再打开止水夹c
c
,使烧杯中的水进入试管丁的操作是双手紧握(或微热)试管丁使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁
双手紧握(或微热)试管丁使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁
.(6)试管丁中的NO2与一定量的O2混合后倒插水中,试管9/10充满水,则原试管丁中的混合气体的平均分子量可能为
42.08或44.04
42.08或44.04
.(保留二位小数)