摘要:量取10.00 mL盐酸应使用 A.酸式滴定管 B.10 mL量筒 C.碱式滴定管 D.100 mL量筒
网址:http://m.1010jiajiao.com/timu3_id_153613[举报]
滴定法是化学定量分析的一种重要而普遍的方法.
I:如图是常温下用0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1某一元酸HX溶液所得滴定曲线.
请回答下列问题:
(1)若学生分组实验需用约400mL0.1000mol?L-1NaOH溶液,配制所需溶液时必需的定量玻璃仪器是______.
(2)判断HX是______(填“强酸”或“弱酸”),理由是______
(3)点①所示溶液中,各离子浓度由大到小的顺序是______.
II:某校化学探究小组用高锰酸钾滴定法测定市场上某品牌钙补品中钙的含量.测定的步骤如下:
①取10.00mL样品,加入适量盐酸酸化,再加入足量的沉淀剂草酸铵[(NH4)2C2O4]溶液,然后慢慢滴加氨水,并调节溶液pH至3.5~4.5之间,产生草酸钙沉淀;
②将沉淀放置过夜或加热半小时使沉淀陈化,过滤、洗涤;
③将洗净的沉淀溶解于适量稀硫酸中,加热至75℃~85℃,用0.1000mol?L-1高锰酸钾溶液滴定至终点,记录消耗的高锰酸钾溶液体积;
④重复上述①~③操作,有关数据记录如表.
(1)判断滴定终点的现象是______.
(2)写出滴定时所发生反应的离子方程式______.
(3)计算样品中钙的含量______g/L.
(4)下列操作会使测量结果偏低的是______.
a.滴定前俯视读数,滴定后仰视读数
b.滴定过程中,不慎将锥形瓶中少量待测液体摇出瓶外
c.滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液
d.沉淀溶解于稀硫酸时,滤纸上仍残留少量固体.
查看习题详情和答案>>
I:如图是常温下用0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1某一元酸HX溶液所得滴定曲线.
请回答下列问题:
(1)若学生分组实验需用约400mL0.1000mol?L-1NaOH溶液,配制所需溶液时必需的定量玻璃仪器是______.
(2)判断HX是______(填“强酸”或“弱酸”),理由是______
(3)点①所示溶液中,各离子浓度由大到小的顺序是______.
II:某校化学探究小组用高锰酸钾滴定法测定市场上某品牌钙补品中钙的含量.测定的步骤如下:
①取10.00mL样品,加入适量盐酸酸化,再加入足量的沉淀剂草酸铵[(NH4)2C2O4]溶液,然后慢慢滴加氨水,并调节溶液pH至3.5~4.5之间,产生草酸钙沉淀;
②将沉淀放置过夜或加热半小时使沉淀陈化,过滤、洗涤;
③将洗净的沉淀溶解于适量稀硫酸中,加热至75℃~85℃,用0.1000mol?L-1高锰酸钾溶液滴定至终点,记录消耗的高锰酸钾溶液体积;
④重复上述①~③操作,有关数据记录如表.
| 实验 | 样品体积/mL | 高锰酸钾溶液体积/mL |
| 1 | 10.00 | 8.98 |
| 2 | 10.00 | 8.58 |
| 3 | 10.00 | 9.02 |
| 4 | 10.00 | 9.00 |
(2)写出滴定时所发生反应的离子方程式______.
(3)计算样品中钙的含量______g/L.
(4)下列操作会使测量结果偏低的是______.
a.滴定前俯视读数,滴定后仰视读数
b.滴定过程中,不慎将锥形瓶中少量待测液体摇出瓶外
c.滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液
d.沉淀溶解于稀硫酸时,滤纸上仍残留少量固体.

滴定法是化学定量分析的一种重要而普遍的方法.
I:如图是常温下用0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1某一元酸HX溶液所得滴定曲线.
请回答下列问题:
(1)若学生分组实验需用约400mL0.1000mol?L-1NaOH溶液,配制所需溶液时必需的定量玻璃仪器是______.
(2)判断HX是______(填“强酸”或“弱酸”),理由是______
(3)点①所示溶液中,各离子浓度由大到小的顺序是______.
II:某校化学探究小组用高锰酸钾滴定法测定市场上某品牌钙补品中钙的含量.测定的步骤如下:
①取10.00mL样品,加入适量盐酸酸化,再加入足量的沉淀剂草酸铵[(NH4)2C2O4]溶液,然后慢慢滴加氨水,并调节溶液pH至3.5~4.5之间,产生草酸钙沉淀;
②将沉淀放置过夜或加热半小时使沉淀陈化,过滤、洗涤;
③将洗净的沉淀溶解于适量稀硫酸中,加热至75℃~85℃,用0.1000mol?L-1高锰酸钾溶液滴定至终点,记录消耗的高锰酸钾溶液体积;
④重复上述①~③操作,有关数据记录如表.
(1)判断滴定终点的现象是______.
(2)写出滴定时所发生反应的离子方程式______.
(3)计算样品中钙的含量______g/L.
(4)下列操作会使测量结果偏低的是______.
a.滴定前俯视读数,滴定后仰视读数
b.滴定过程中,不慎将锥形瓶中少量待测液体摇出瓶外
c.滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液
d.沉淀溶解于稀硫酸时,滤纸上仍残留少量固体.
 查看习题详情和答案>>
查看习题详情和答案>>
I:如图是常温下用0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1某一元酸HX溶液所得滴定曲线.
请回答下列问题:
(1)若学生分组实验需用约400mL0.1000mol?L-1NaOH溶液,配制所需溶液时必需的定量玻璃仪器是______.
(2)判断HX是______(填“强酸”或“弱酸”),理由是______
(3)点①所示溶液中,各离子浓度由大到小的顺序是______.
II:某校化学探究小组用高锰酸钾滴定法测定市场上某品牌钙补品中钙的含量.测定的步骤如下:
①取10.00mL样品,加入适量盐酸酸化,再加入足量的沉淀剂草酸铵[(NH4)2C2O4]溶液,然后慢慢滴加氨水,并调节溶液pH至3.5~4.5之间,产生草酸钙沉淀;
②将沉淀放置过夜或加热半小时使沉淀陈化,过滤、洗涤;
③将洗净的沉淀溶解于适量稀硫酸中,加热至75℃~85℃,用0.1000mol?L-1高锰酸钾溶液滴定至终点,记录消耗的高锰酸钾溶液体积;
④重复上述①~③操作,有关数据记录如表.
| 实验 | 样品体积/mL | 高锰酸钾溶液体积/mL |
| 1 | 10.00 | 8.98 |
| 2 | 10.00 | 8.58 |
| 3 | 10.00 | 9.02 |
| 4 | 10.00 | 9.00 |
(2)写出滴定时所发生反应的离子方程式______.
(3)计算样品中钙的含量______g/L.
(4)下列操作会使测量结果偏低的是______.
a.滴定前俯视读数,滴定后仰视读数
b.滴定过程中,不慎将锥形瓶中少量待测液体摇出瓶外
c.滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液
d.沉淀溶解于稀硫酸时,滤纸上仍残留少量固体.
 查看习题详情和答案>>
查看习题详情和答案>>
用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有
(2)取10.00mL待测液,用
(3)用0.2010mol?L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视
(4)根据下列数据,烧碱的纯度为
(5)排去碱式滴定管中气泡的方法应采用操作

(6)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、锥形瓶用蒸馏水洗后又用待测液润洗
E、滴定到指示剂刚变色,摇动锥形瓶后颜色褪去,没再继续滴定
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
查看习题详情和答案>>
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有
250mL容量瓶
250mL容量瓶
、胶头滴管
胶头滴管
.(2)取10.00mL待测液,用
碱
碱
式滴定管量取.(3)用0.2010mol?L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视
锥形瓶中溶液颜色的变化
锥形瓶中溶液颜色的变化
,直到滴定到终点.(4)根据下列数据,烧碱的纯度为
93.5%
93.5%
.(用百分数表示)| 滴定次数 | 待测液体积 (mL) |
标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
丙
丙
(填“甲”、“乙”、“丙”),然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(6)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有
ABDF
ABDF
.(多选扣分)A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、锥形瓶用蒸馏水洗后又用待测液润洗
E、滴定到指示剂刚变色,摇动锥形瓶后颜色褪去,没再继续滴定
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10).试回答:
(1)在25℃时,1L水中约能溶解0.01g碳酸钡,则该温度下碳酸钡的溶度积Ksp= .
(2)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用 指示剂,理由是 ;
判断到达滴定终点的实验现象是 .
(3)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol?L-1的盐酸标准液进行滴定,相关数据记录如表
①实验3到达滴定终点时所耗HCl溶液的体积为 ;依据表中数据,计算出烧碱样品中含NaOH的质量分数为 %.(小数点后保留两位数字)
②滴定时的正确操作是 .
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数.
查看习题详情和答案>>
(1)在25℃时,1L水中约能溶解0.01g碳酸钡,则该温度下碳酸钡的溶度积Ksp=
(2)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用
判断到达滴定终点的实验现象是
(3)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol?L-1的盐酸标准液进行滴定,相关数据记录如表
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.00 | 31.00 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
②滴定时的正确操作是
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数.
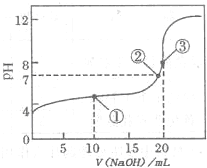 (2011?巢湖二模)滴定法是化学定量分析的一种重要而普遍的方法.
(2011?巢湖二模)滴定法是化学定量分析的一种重要而普遍的方法.I:如图是常温下用0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1某一元酸HX溶液所得滴定曲线.
请回答下列问题:
(1)若学生分组实验需用约400mL0.1000mol?L-1NaOH溶液,配制所需溶液时必需的定量玻璃仪器是
500mL容量瓶
500mL容量瓶
.(2)判断HX是
弱酸
弱酸
(填“强酸”或“弱酸”),理由是当NaOH溶液滴加至20mL时,溶液pH大于7,或滴加至溶液pH等于7时,需要的NaOH溶液体积小于20mL,或从图中可看出0.1000mol?L-1HX的pH大于1
当NaOH溶液滴加至20mL时,溶液pH大于7,或滴加至溶液pH等于7时,需要的NaOH溶液体积小于20mL,或从图中可看出0.1000mol?L-1HX的pH大于1
(3)点①所示溶液中,各离子浓度由大到小的顺序是
c(X-)>c(Na+)>c(H+)>c(OH-)
c(X-)>c(Na+)>c(H+)>c(OH-)
.II:某校化学探究小组用高锰酸钾滴定法测定市场上某品牌钙补品中钙的含量.测定的步骤如下:
①取10.00mL样品,加入适量盐酸酸化,再加入足量的沉淀剂草酸铵[(NH4)2C2O4]溶液,然后慢慢滴加氨水,并调节溶液pH至3.5~4.5之间,产生草酸钙沉淀;
②将沉淀放置过夜或加热半小时使沉淀陈化,过滤、洗涤;
③将洗净的沉淀溶解于适量稀硫酸中,加热至75℃~85℃,用0.1000mol?L-1高锰酸钾溶液滴定至终点,记录消耗的高锰酸钾溶液体积;
④重复上述①~③操作,有关数据记录如表.
| 实验 | 样品体积/mL | 高锰酸钾溶液体积/mL |
| 1 | 10.00 | 8.98 |
| 2 | 10.00 | 8.58 |
| 3 | 10.00 | 9.02 |
| 4 | 10.00 | 9.00 |
当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,且半分钟不褪色
当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,且半分钟不褪色
.(2)写出滴定时所发生反应的离子方程式
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
.(3)计算样品中钙的含量
9.00
9.00
g/L.(4)下列操作会使测量结果偏低的是
b、d
b、d
.a.滴定前俯视读数,滴定后仰视读数
b.滴定过程中,不慎将锥形瓶中少量待测液体摇出瓶外
c.滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液
d.沉淀溶解于稀硫酸时,滤纸上仍残留少量固体.