网址:http://m.1010jiajiao.com/timu3_id_153612[举报]
配制一定体积的溶液,要用到一种特殊的仪器:容量瓶。
(1)使用容量瓶时应遵循以下原则:首先,选择___________的容量瓶;其次,尽可能将________转移到容量瓶中;第三,确保向容量瓶中加水时不超过___________________。
(2)某同学A想从试剂瓶内取出95mL的NaOH溶液,A能否用规格为100mL的容量瓶来取?为什么?
(3)某同学B在配制一定浓度的NaCl溶液时,当B将烧杯里的溶液注入容量瓶中时,发现瓶内液体的液面恰好达到容量瓶的刻度线,这个巧合令B非常高兴。请你分析B所配制的溶液浓度是否准确?为什么?
(4)某同学C在配制一定浓度的NaCl溶液时,在最后加水时,发现液面略微超出刻度线,C用滴管将上面的液体吸取出来。你认为这个做法可取吗?为什么?
(5)某同学D在配制一定浓度的NaOH溶液时,当D将称量好的NaOH固体溶解在水中后,迅速、完全地将溶液转移到容量瓶中,然后加水至刻度线。你认为D的做法有无错误?为什么?
查看习题详情和答案>>(1)若配制大约1 mol·L-1的溶液100 mL,所给仪器只有托盘天平、量筒、带刻度的烧杯、玻璃棒,下列可选用的试剂是__________(选填字母序号)。
A.氢氧化钠固体 B.浓硫酸(98%) C.浓盐酸(37%) D.浓硝酸(63%)
(2)下图是某学生在配制0.100 mol·L-1的碳酸钠溶液100 mL时,将第一次洗涤液转移到容量瓶内的操作。
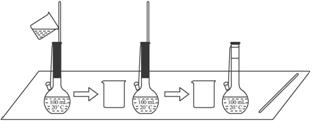
该步操作对所得溶液浓度的影响是__________(填“偏高”“偏低”或“无影响”),原因是_______
_____________________________________________________________________。
(3)若配制(2)中溶液时,该生使用托盘天平称取碳酸钠,则与计算量一致吗?为什么?_______
____________________________________________________________________。
(4)现用移液管准确量取20.0 mL 0.100 mol·L-1的碳酸钠溶液,注入锥形瓶中滴加甲基橙试剂2—3滴,此时溶液呈__________色。然后将待测稀盐酸注入洁净、干燥的滴定管内,记下滴定管内稀盐酸的初始刻度读数,接着开始向锥形瓶内滴加盐酸。当锥形瓶内溶液颜色突变成__________色时即达到滴定终点,此时消耗盐酸体积为21.36 mL,则待测盐酸的浓度为__________ mol·L-1。
查看习题详情和答案>>配制一定物质的量浓度的溶液是实验室进行科学研究的重要环节。
(1)若配制大约1 mol·L-1叫的溶液100 mL,所给仪器只有托盘天平、量筒、带刻度的烧杯、玻璃棒,下列可选用的试剂是 (填字母序号)。
A.氢氧化钠固体B.浓硫酸(98%) C.浓盐酸(37%) D.浓硝酸(63%)
(2)下图是某学生在配制0.100 mol·L-1的碳酸钠溶液100 mL时,将第一次洗涤液转移到容量瓶内的操作。
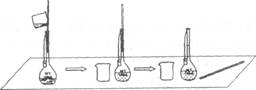
该步操作对所得溶液浓度的影响是 (填“偏高”、“偏低”或“无影响”),原因是
.
(3)若配制(2)中溶液时,该生使用托盘天平称取碳酸钠,则与计算量一致吗?为什么?
.
(4)现用移液管准确量取20.0 mI。0.100 mol·L-1盼碳酸钠溶液,注入锥形瓶中滴加甲基橙试剂2~3滴,此时溶液呈 色。然后将待测稀盐酸注入洁净、干燥的滴定管内,记下滴定管内稀盐酸的初始刻度读数,接着开始向锥形瓶内滴加盐酸。当锥形瓶内溶液颜色突变成 色时即达到滴定终点,此时消耗盐酸体积为21.36 mI。,则待测盐酸的浓度为 mol·L-1。
查看习题详情和答案>>(1)若配制大约1 mol·L-1叫的溶液100 mL,所给仪器只有托盘天平、量筒、带刻度的烧杯、玻璃棒,下列可选用的试剂是 (填字母序号)。
| A.氢氧化钠固体 | B.浓硫酸(98%) | C.浓盐酸(37%) | D.浓硝酸(63%) |

该步操作对所得溶液浓度的影响是 (填“偏高”、“偏低”或“无影响”),原因是
.
(3)若配制(2)中溶液时,该生使用托盘天平称取碳酸钠,则与计算量一致吗?为什么?
.
(4)现用移液管准确量取20.0 mI。0.100 mol·L-1盼碳酸钠溶液,注入锥形瓶中滴加甲基橙试剂2~3滴,此时溶液呈 色。然后将待测稀盐酸注入洁净、干燥的滴定管内,记下滴定管内稀盐酸的初始刻度读数,接着开始向锥形瓶内滴加盐酸。当锥形瓶内溶液颜色突变成 色时即达到滴定终点,此时消耗盐酸体积为21.36 mI。,则待测盐酸的浓度为 mol·L-1。
有一未知浓度的食醋,某学生为测定CH3COOH的浓度在实验室中进行如下实验。请完成下列填空:
(1)配制100 mL 0.10 mol·L-1NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)________→洗涤(并将洗涤液移入容量瓶)→________→________→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量0.4 g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、________、________。
(2)取20.00 mL待测食醋放入锥形瓶中,由于食醋颜色较深,我们先____________________________________,并滴加2~3滴________做指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
|
实验 编号 |
NaOH溶液的浓度/(mol·L-1) |
滴定完成时,NaOH溶液滴入的体积/mL |
待测CH3COOH溶液的体积/mL |
|
1 |
0.10 |
22.62 |
20.00 |
|
2 |
0.10 |
22.72 |
20.00 |
|
3 |
0.10 |
22.80 |
20.00 |
①滴定达到终点的标志是
________________________________________________________________________。
②根据上述数据,可计算出该食醋中CH3COOH的浓度约为________(保留两位有效数字)。
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________。
A.滴定终点时俯视读数
B.移液管水洗后未用食醋溶液润洗
C.锥形瓶水洗后未干燥
D.称量前NaOH固体中混有Na2CO3固体
E.配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F.碱式滴定管尖嘴部分有气泡,滴定后消失
查看习题详情和答案>>