摘要:氧化还原反应方程式的配平 1) Zn+ HNO3(稀)-- Zn(NO3)2 + N2O + H2O 2) Fe(NO3)3+ NaOH+ Cl2-- Na2FeO4+ NaNO3+ NaCl+ H2O. 3) KMnO4+ KNO2+ -- Mn SO4+ K2SO4+ KNO3 + H2O 4) MnO4-+ H2O2+ -- Mn2++ H2O+ O2↑ 5) KCN+ Cl2+ NaOH-- CO2+ N2+ KCl+ NaCl+ H2O 6) Cu2S+ HNO3-- Cu(NO3)2+ H2SO4+ NO + 7) Fe(OH)3+ ClO-+ = FeO42-+ Cl-+ H2O 8) KI+ KIO3+ H2SO4-- K2SO4+ I2+ H2O
网址:http://m.1010jiajiao.com/timu3_id_153591[举报]
某一反应体系中存在以下五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI
(1)若水是产物,试用这五种物质组成一个合理的反应方程式,配平并标出电子转移的方向和数目:______;
(2)当pH为5~9时,该反应体系中的氧化反应为由HI→I2;当pH<4时,反应向逆反应方向进行,此时体系中的氧化反应为由______→______.如果两种情况下反应中转移电子数相等,则两个反应中氧化剂的物质的量之比是______;
(3)物质的氧化性和还原性不仅与溶液的酸碱性有关,还与物质的浓度和反应温度等因素有关.下列各组物质由于浓度不同而发生不同氧化还原反应的是(填序号)______.
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Fe与HCl溶液 ④Zn与H2SO4溶液.
查看习题详情和答案>>
某一反应体系中存在以下五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI
(1)若水是产物,试用这五种物质组成一个合理的反应方程式,配平并标出电子转移的方向和数目:______;
(2)当pH为5~9时,该反应体系中的氧化反应为由HI→I2;当pH<4时,反应向逆反应方向进行,此时体系中的氧化反应为由______→______.如果两种情况下反应中转移电子数相等,则两个反应中氧化剂的物质的量之比是______;
(3)物质的氧化性和还原性不仅与溶液的酸碱性有关,还与物质的浓度和反应温度等因素有关.下列各组物质由于浓度不同而发生不同氧化还原反应的是(填序号)______.
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Fe与HCl溶液 ④Zn与H2SO4溶液.
查看习题详情和答案>>
(1)若水是产物,试用这五种物质组成一个合理的反应方程式,配平并标出电子转移的方向和数目:______;
(2)当pH为5~9时,该反应体系中的氧化反应为由HI→I2;当pH<4时,反应向逆反应方向进行,此时体系中的氧化反应为由______→______.如果两种情况下反应中转移电子数相等,则两个反应中氧化剂的物质的量之比是______;
(3)物质的氧化性和还原性不仅与溶液的酸碱性有关,还与物质的浓度和反应温度等因素有关.下列各组物质由于浓度不同而发生不同氧化还原反应的是(填序号)______.
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Fe与HCl溶液 ④Zn与H2SO4溶液.
某一反应体系中存在以下五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI
(1)若水是产物,试用这五种物质组成一个合理的反应方程式,配平并标出电子转移的方向和数目:______;
(2)当pH为5~9时,该反应体系中的氧化反应为由HI→I2;当pH<4时,反应向逆反应方向进行,此时体系中的氧化反应为由______→______.如果两种情况下反应中转移电子数相等,则两个反应中氧化剂的物质的量之比是______;
(3)物质的氧化性和还原性不仅与溶液的酸碱性有关,还与物质的浓度和反应温度等因素有关.下列各组物质由于浓度不同而发生不同氧化还原反应的是(填序号)______.
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Fe与HCl溶液 ④Zn与H2SO4溶液.
查看习题详情和答案>>
(1)若水是产物,试用这五种物质组成一个合理的反应方程式,配平并标出电子转移的方向和数目:______;
(2)当pH为5~9时,该反应体系中的氧化反应为由HI→I2;当pH<4时,反应向逆反应方向进行,此时体系中的氧化反应为由______→______.如果两种情况下反应中转移电子数相等,则两个反应中氧化剂的物质的量之比是______;
(3)物质的氧化性和还原性不仅与溶液的酸碱性有关,还与物质的浓度和反应温度等因素有关.下列各组物质由于浓度不同而发生不同氧化还原反应的是(填序号)______.
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Fe与HCl溶液 ④Zn与H2SO4溶液.
查看习题详情和答案>>
(2008?郑州一模)某一反应体系中存在以下五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI
(1)若水是产物,试用这五种物质组成一个合理的反应方程式,配平并标出电子转移的方向和数目: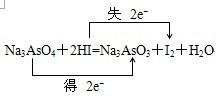
 ;
;
(2)当pH为5~9时,该反应体系中的氧化反应为由HI→I2;当pH<4时,反应向逆反应方向进行,此时体系中的氧化反应为由
(3)物质的氧化性和还原性不仅与溶液的酸碱性有关,还与物质的浓度和反应温度等因素有关.下列各组物质由于浓度不同而发生不同氧化还原反应的是(填序号)
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Fe与HCl溶液 ④Zn与H2SO4溶液.
查看习题详情和答案>>
(1)若水是产物,试用这五种物质组成一个合理的反应方程式,配平并标出电子转移的方向和数目:


(2)当pH为5~9时,该反应体系中的氧化反应为由HI→I2;当pH<4时,反应向逆反应方向进行,此时体系中的氧化反应为由
Na3AsO3
Na3AsO3
→Na3AsO4
Na3AsO4
.如果两种情况下反应中转移电子数相等,则两个反应中氧化剂的物质的量之比是1:1
1:1
;(3)物质的氧化性和还原性不仅与溶液的酸碱性有关,还与物质的浓度和反应温度等因素有关.下列各组物质由于浓度不同而发生不同氧化还原反应的是(填序号)
①④
①④
.①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Fe与HCl溶液 ④Zn与H2SO4溶液.
已知硝酸与金属反应时,在不同条件下有不同的还原产物,甚至在同一反应中可同时得到多种还原产物。现有HNO3、NH4NO3、N2O、H2O、Zn、Zn(NO3)2六种物质。
(1)请利用其中五种物质组成一个完整的化学反应,写出该化学反应方程式:
;
(2)上述所写反应中,硝酸表现出的化学性质是 ,被还原的元素是 。
(3)若六种物质组成一个完整的化学反应,则反应中的还原产物是 (填化学式),若该反应中NH4NO3与N2O物质的量之比为1︰1,那么该反应中氧化剂与还原剂的物质的量之比为 。
(4)若六种物质组成一个完整的化学反应,且没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组。原因是 。
查看习题详情和答案>>