摘要:16.( )20mL 0.05mol/L含有R2O72-离子的浓溶液恰好能将20mL 0.3mol/L的Fe2+溶液完全氧化.则元素R在还原产物中的化合价为 A.+2价 B.+3价 C.+4价 D.+5价
网址:http://m.1010jiajiao.com/timu3_id_153584[举报]
利用海水脱硫是处理火力发电排放出SO2的一种有效的方法,其工艺流如图所示:
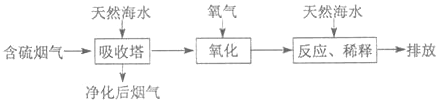
(1)天然海水呈碱性,写出SO2与OH-反应的离子方程式 .
(2)天然海水吸收了含硫烟气后会溶有H2SO3分子,使用氧气将其氧化的化学原理是 (用化学方程式表示).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是 .
(3)为了测定炉气中SO2的体积百分含量,把500mL的炉气通入20mL 0.05mol/L的高锰酸钾溶液中,恰好使紫色刚好褪去.请回答:
①配平方程式: KMnO4-+ SO2+ H2O═ Mn2++ SO42-+
②测定结果炉气中SO2的含量为 .
(4)已知工业上利用可逆反应2SO2+O2
2SO3,△H<0,来制备硫酸,下列对该反应的说法正确的是 .
A.当单位时间内消耗2mol SO2的同时生成2mol SO3,说明该反应达到平衡
B.升高温度,可以增大正反应速率
C.恒容,通入氩气增大压强,促使平衡向右移动
D.工业上通过鼓入大量的空气而提高SO2的转化率
(5)某科研小组利用SO2、O2和稀H2SO4设计成原电池,该电池的负极反应为: .
查看习题详情和答案>>

(1)天然海水呈碱性,写出SO2与OH-反应的离子方程式
(2)天然海水吸收了含硫烟气后会溶有H2SO3分子,使用氧气将其氧化的化学原理是
(3)为了测定炉气中SO2的体积百分含量,把500mL的炉气通入20mL 0.05mol/L的高锰酸钾溶液中,恰好使紫色刚好褪去.请回答:
①配平方程式:
②测定结果炉气中SO2的含量为
(4)已知工业上利用可逆反应2SO2+O2
| 加热 | △ |
A.当单位时间内消耗2mol SO2的同时生成2mol SO3,说明该反应达到平衡
B.升高温度,可以增大正反应速率
C.恒容,通入氩气增大压强,促使平衡向右移动
D.工业上通过鼓入大量的空气而提高SO2的转化率
(5)某科研小组利用SO2、O2和稀H2SO4设计成原电池,该电池的负极反应为:
向20mL 0.05mol·L−1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A.x=20时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-)
B.x=20时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+)
C.x=60时,溶液中有Ba2+、Al3+、OH-,且c(OH-) = c(Ba2+)
D.x=60时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
查看习题详情和答案>>
向20mL 0.05mol·L?1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
| A.x=20时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-) |
| B.x=20时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+) |
| C.x=60时,溶液中有Ba2+、Al3+、OH-,且c(OH-) = c(Ba2+) |
| D.x=60时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-) |