网址:http://m.1010jiajiao.com/timu3_id_153449[举报]
①将固体混合物溶于水,搅拌后,得无色溶液;
②在此溶液中滴入氯化钡溶液,有白色沉淀生成;
③过滤,然后在此白色沉淀中加入足量稀硝酸,沉淀最后全部消失。
由此推断:固体中肯定有________________,肯定没有______________,可能会有_________________。如果要进一步确定可能有的物质是否存在,可采用的检验方法是______________________________________________________________。
查看习题详情和答案>>有一固体,可能由碳酸钠、硫酸钠、硫酸铜、氯化钙、氯化钠中的一种或几种组成。为鉴别它们,做了如下实验:
①将固体混合物溶于水,搅拌后,得无色溶液。
②在此溶液中滴入氯化钡溶液,有白色沉淀生成。
③过滤,然后在此白色沉淀中加入足量稀硝酸,沉淀最后全部消失。
由此推断:固体中肯定有 ,肯定没有 ,可能会有 。如果要进一步确定可能有的物质是否存在,可采用的检验方法是 。
查看习题详情和答案>>有一固体,可能由碳酸钠、硫酸钠、硫酸铜、氯化钙、氢化钠中的一种
或几种组成.为鉴别它们,做了如下实验:
①将固体混合物溶于水,搅拌后,得无色溶液;
②在此溶液中滴人氯化钡溶液,有白色沉淀生成;
③过滤,然后在此白色沉淀中加入足量稀硝酸,沉淀最后全部消失.
由此推断:固体中肯定有________,肯定没有________,可能会有________.如果要进一步确定可能有的物质是否存在,可采用的检验方法是________________________________.
查看习题详情和答案>>有一固体,可能由碳酸钠、硫酸钠、硫酸铜、氯化钙、氢化钠中的一种
或几种组成.为鉴别它们,做了如下实验:
①将固体混合物溶于水,搅拌后,得无色溶液;
②在此溶液中滴人氯化钡溶液,有白色沉淀生成;
③过滤,然后在此白色沉淀中加入足量稀硝酸,沉淀最后全部消失.
由此推断:固体中肯定有________,肯定没有________,可能会有________.如果要进一步确定可能有的物质是否存在,可采用的检验方法是________________________________.
查看习题详情和答案>>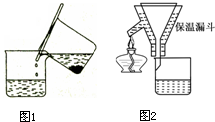 硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下:
硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下:步骤1:铁屑的处理.将废铁屑放入热的碳酸钠溶液中浸泡几分钟后用图1所示方法分离出固体并洗涤、干燥.步骤2:FeSO4溶液的制备.将处理好的铁屑放入锥形瓶,加入过量的3mol?L-1H2SO4溶液,加热至充分反应为止.趁热过滤(如图2所示),收集滤液和洗涤液.
步骤3:硫酸亚铁铵的制备.向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过加热浓缩、冷却结晶、过滤、乙醇洗涤后得到硫酸亚铁铵晶体.
请回答下列问题:
(1)步骤1中图1分离方法称为
(2)步骤2中有一处明显不合理的是
(3)步骤3加热浓缩过程中,当
(4)FeSO4?7H2O在潮湿的空气中易被氧化成Fe(OH)SO4?3H2O,写出该反应的化学方程式