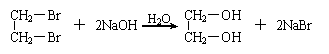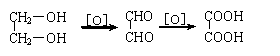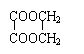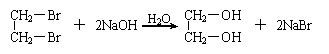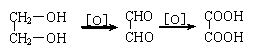摘要: 已知以下反应 (1)2BrO3-+Cl2=2ClO3-+Br2 (2)ClO3-+5Cl-+6H+=3H2O+3Cl2 (3)5Cl2+I2+6H2O=2HIO3+10HCl 以下各微粒的氧化能力由强而弱的顺序应是() (A)Cl2>BrO3->ClO3->IO3- (B)BrO3->ClO3->IO3->Cl2 (C)BrO3->Cl2>ClO3->IO3- (D)BrO3->ClO3->Cl2>IO3- 翰林汇
网址:http://m.1010jiajiao.com/timu3_id_153231[举报]
已知以下反应的热化学方程式
①CH3COOH(l)+2O2(g)![]() 2CO2(g)+2H2O(l) ΔH(298 K)=-870.3 kJ·mol-1
2CO2(g)+2H2O(l) ΔH(298 K)=-870.3 kJ·mol-1
②C(s)+O2(g) ![]() CO2(g) ΔH(298 K)=-393.5 kJ·mol-1
CO2(g) ΔH(298 K)=-393.5 kJ·mol-1
③H2(g)+![]() O 2(g)
O 2(g) ![]() H2O(l) ΔH=-285.5 kJ·mol-1
H2O(l) ΔH=-285.5 kJ·mol-1
试求:④![]() CH3COOH(l)的ΔH。
CH3COOH(l)的ΔH。
已知以下反应的热化学方程式:?
①CH3COOH(l)+2O2(g)![]() 2CO2(g)+2H2O(l) ΔH(298 K)=-870.3 kJ·mol-1?
2CO2(g)+2H2O(l) ΔH(298 K)=-870.3 kJ·mol-1?
②C(s)+O2(g)![]() CO2(g) ΔH(298 K)=-393.5 kJ·mol-1?
CO2(g) ΔH(298 K)=-393.5 kJ·mol-1?
③H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
试求:④![]() CH3COOH(l)的ΔH。?
CH3COOH(l)的ΔH。?
Ⅰ.设反应①Fe(s)+CO2(g) ) FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
(1)从上表可推断,反应①是
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g);△H=Q3平衡常数为K3.
CO(g)+H2O(g);△H=Q3平衡常数为K3.
根据反应①与②推导出K1、K2、K3的关系式K3=
;
可推断反应③是
A.缩小容器体积;B.降低温度;C.使用合适的催化剂;D.设法减少CO的量;E.升高温度
(3)根据反应①与②推导出Q1、Q2、Q3的关系式Q3=
Ⅱ.某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2 只发生了如下过程:H2O2→O2.
(1)该反应应选择的酸是:
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸.
(2)该反应中发生还原反应的过程是:
(3)写出该反应配平的离子方程式并标出电子转移的方向和数目:

(4)如果上述反应中有6.72L(标准状况.)气体生成,转移的电子数为
(5)H2O2有时可作为矿业废液消毒剂,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,试指出生成物A的化学式为
(6)H2O2还有“绿色氧化剂”的美称,阐明H2O2被称为绿色氧化剂的理由是
查看习题详情和答案>>
 FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1 173 | 2.15 | 1.67 |
吸
吸
(填“放”或“吸”)热反应.(2)现有反应③H2(g)+CO2(g)
 CO(g)+H2O(g);△H=Q3平衡常数为K3.
CO(g)+H2O(g);△H=Q3平衡常数为K3.根据反应①与②推导出K1、K2、K3的关系式K3=
| k1 |
| k2 |
| k1 |
| k2 |
可推断反应③是
吸
吸
(填“放”或“吸”)热反应.要使反应③在一定条件下建立的平衡右移,可采取的措施有DE
DE
.A.缩小容器体积;B.降低温度;C.使用合适的催化剂;D.设法减少CO的量;E.升高温度
(3)根据反应①与②推导出Q1、Q2、Q3的关系式Q3=
Q1-Q2
Q1-Q2
.Ⅱ.某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2 只发生了如下过程:H2O2→O2.
(1)该反应应选择的酸是:
C
C
(填序号).A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸.
(2)该反应中发生还原反应的过程是:
MnO4-
MnO4-
→Mn2+
Mn2+
.(3)写出该反应配平的离子方程式并标出电子转移的方向和数目:


(4)如果上述反应中有6.72L(标准状况.)气体生成,转移的电子数为
0.6
0.6
mol.(5)H2O2有时可作为矿业废液消毒剂,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,试指出生成物A的化学式为
KHCO3
KHCO3
.(6)H2O2还有“绿色氧化剂”的美称,阐明H2O2被称为绿色氧化剂的理由是
H2O2是氧化剂,其产物是H2O;H2O没有毒性及污染性
H2O2是氧化剂,其产物是H2O;H2O没有毒性及污染性
.