摘要:5.下列说法正确的是 A.同一元素可能有若干种不同的同位素 B.氢元素有3种不同的核素
网址:http://m.1010jiajiao.com/timu3_id_153118[举报]
下列说法中,正确的是
| A.两种物质的组成元素相同,各元素的质量分数也相同,则两者一定互为同分异构体 |
| B.分子式为CnH2n的化合物,可能使酸性KMnO4溶液褪色,也可能不使其褪色 |
| C.通式相同,分子组成上相差一个或若干个CH2原子团的化合物,一定互为同系物 |
| D.凡含有苯环的物质都是芳香烃 |
下列说法中,正确的是
| A.两种物质的组成元素相同,各元素的质量分数也相同,则两者一定互为同分异构体 |
| B.分子式为CnH2n的化合物,可能使酸性KMnO4溶液褪色,也可能不使其褪色 |
| C.通式相同,分子组成上相差一个或若干个CH2原子团的化合物,一定互为同系物 |
| D.凡含有苯环的物质都是芳香烃 |
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.
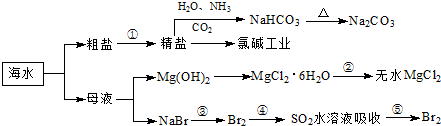
回答下列有关问题.
(1)下列有关说法正确的是 .
A.目前国际上主要使用蒸馏法的“海水淡化”技术,得高纯度淡水
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.在第③、④、⑤步骤中,溴元素均被氧化
D.工业上通过电解饱和NaCl溶液制取金属钠
(2)写出第③步骤的化学反应方程式 .
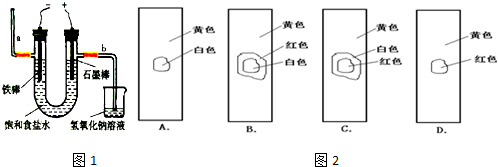
(3)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”. 氯气的工业制取装置如图1,回答:
①若饱和食盐水中含有酚酞,通电后 (填a或b)侧先变红.
②电解反应的化学方程式为 .
③氯气制成氯水,用玻璃棒蘸取新制氯水滴在pH试纸中部,观察到的现象是 .
(4)工业上以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:
NH3+CO2+H2O═NH4HCO3;
NH4HCO3+NaCl═NaHCO3↓+NH4Cl;
2NaHCO3
Na2CO3+CO2↑+H2O
某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图3所示(图中夹持、固定用的仪器未画出).试回答下列有关问题:
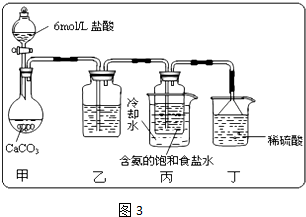
Ⅰ、乙装置中的试剂是 ,其作用是 .
Ⅱ、丁装置中稀硫酸的作用是 .
Ⅲ、实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称),该操作所需要的玻璃仪器有 .
②碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为 .
③请你再设计出一种实验室制取少量碳酸氢钠的方法: .
查看习题详情和答案>>

回答下列有关问题.
(1)下列有关说法正确的是
A.目前国际上主要使用蒸馏法的“海水淡化”技术,得高纯度淡水
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.在第③、④、⑤步骤中,溴元素均被氧化
D.工业上通过电解饱和NaCl溶液制取金属钠
(2)写出第③步骤的化学反应方程式
(3)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”. 氯气的工业制取装置如图1,回答:
①若饱和食盐水中含有酚酞,通电后
②电解反应的化学方程式为
③氯气制成氯水,用玻璃棒蘸取新制氯水滴在pH试纸中部,观察到的现象是

(4)工业上以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:
NH3+CO2+H2O═NH4HCO3;
NH4HCO3+NaCl═NaHCO3↓+NH4Cl;
2NaHCO3
| ||
某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图3所示(图中夹持、固定用的仪器未画出).试回答下列有关问题:

Ⅰ、乙装置中的试剂是
Ⅱ、丁装置中稀硫酸的作用是
Ⅲ、实验结束后,分离出NaHCO3 晶体的操作是
②碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为
③请你再设计出一种实验室制取少量碳酸氢钠的方法:
(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式: 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a. NH3 b. HI c. SO2 d . CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。 查看习题详情和答案>>
(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式: 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a. NH3 b. HI c. SO2 d . CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式: 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a. NH3 b. HI c. SO2 d . CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。