摘要:10.R元素的原子有3个电子层.M层电子数是K层电子数的3倍.对R元素的判断不正确的是 A.R元素处于3周期ⅥA族 B.R元素是较活泼的非金属元素 C.原子核外共有14个电子 D.元素最低化合价为-2价
网址:http://m.1010jiajiao.com/timu3_id_153101[举报]
R元素的原子有三个电子层,M层电子数是K层电子数的3倍,对R元素的判断不正确的是 ( )
A.R元素处于第三周期ⅥA族 B.R元素是非金属元素
C.原子核外共有14个电子 D.R元素最低化合价为-2
查看习题详情和答案>>R元素的原子有三个电子层,M层电子数是K层电子数的3倍,对R元素的判断不正确的是
- A.R元素处于第三周期ⅥA族
- B.R元素是非金属元素
- C.原子核外共有14个电子
- D.R元素最低化合价为-2
|
R元素的原子有三个电子层,M层电子数是K层电子数的3倍,对R元素的判断不正确的是 | |
A. |
R元素处于第三周期ⅥA族 |
B. |
R元素是非金属元素 |
C. |
原子核外共有14个电子 |
D. |
R元素最低化合价为-2 |
(14分)下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
(1)T3+的核外电子排布式是:
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示)
(3)根据下列说法填空:
①G单质的熔点高于J单质,是因为
②将J2M2溶于水,要破坏 (离子键、极性共价键、非极性共价键)
③RE3沸点高于QE4,是因为
④一个Q2E4分子中E的 轨道与Q的 轨道形成σ键。
(4)G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)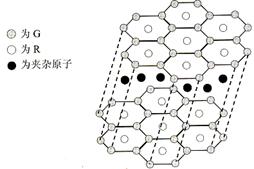

(1)T3+的核外电子排布式是:
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示)
(3)根据下列说法填空:
①G单质的熔点高于J单质,是因为
②将J2M2溶于水,要破坏 (离子键、极性共价键、非极性共价键)
③RE3沸点高于QE4,是因为
④一个Q2E4分子中E的 轨道与Q的 轨道形成σ键。
(4)G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)