摘要:有关 1224Mg中“24 的叙述正确的是( ) A.它表示镁元素的原子相对质量为24 B.它表示镁元素的原子序数为24 C.它表示镁元素的一种同位素的质量数为24 D.它表示镁元素的一种同位素的原子量为24
网址:http://m.1010jiajiao.com/timu3_id_152792[举报]
铁及铁的化合物应用广泛,如FeCl3可用做催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图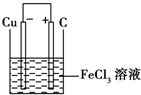
 (标出正、负极材料及电解质溶液),并写出电极反应式.正极反应
(标出正、负极材料及电解质溶液),并写出电极反应式.正极反应
(3)某科研人员发现劣质不锈钢在某些盐溶液中腐蚀现象明显.请从提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀.有关反应的化学方程式①
(4)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2.该电池正极发生的电极反应为
查看习题详情和答案>>
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是
2Fe3++Cu═2Fe2++Cu2+
2Fe3++Cu═2Fe2++Cu2+
.(2)若将(1)中的反应设计成原电池,请画出原电池的装置图


2Fe3++2e-═2Fe2+或Fe3++e-═2e2+
2Fe3++2e-═2Fe2+或Fe3++e-═2e2+
,负极反应Cu-2e-═Cu2+
Cu-2e-═Cu2+
.(3)某科研人员发现劣质不锈钢在某些盐溶液中腐蚀现象明显.请从提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀.有关反应的化学方程式①
CuO+H2SO4═CuSO4+H2O
CuO+H2SO4═CuSO4+H2O
②CuSO4+Fe═FeSO4+Cu
CuSO4+Fe═FeSO4+Cu
.劣质不锈钢腐蚀的实验现象不锈钢表面有红色物质生成,溶液颜色由蓝色变成浅绿色
不锈钢表面有红色物质生成,溶液颜色由蓝色变成浅绿色
.(4)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2.该电池正极发生的电极反应为
2SOCl2+4e-═4Cl-+S+SO2
2SOCl2+4e-═4Cl-+S+SO2
.电视剧《西游记》中仙境美仑美奂,这些神话仙境中所需的烟雾是用NH4NO3和Zn粉按质量比8:6.5混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟.又知发生反应后有N2和水生成.有关的说法中正确的是( )
①水起着溶解NH4NO3,发生吸热现象以启动反应的发生的作用;②每还原1mol NO3-需氧化1molNH4+和1mol Zn;
③成烟物质是两性氧化物小颗粒;④成烟物质是小锌粒,它由NH4NO3反应放热而蒸出.
①水起着溶解NH4NO3,发生吸热现象以启动反应的发生的作用;②每还原1mol NO3-需氧化1molNH4+和1mol Zn;
③成烟物质是两性氧化物小颗粒;④成烟物质是小锌粒,它由NH4NO3反应放热而蒸出.
查看习题详情和答案>>
下列对化学平衡有关的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)?CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)?2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,H2的转化率一定升高
③可逆反应2SO2+O2?2SO3,当混合气体的密度一定时,反应一定达到平衡
④有气体参加的反应达平衡时,应当有V正(气)=V逆(气)=0.
①已达平衡的反应C(s)+H2O(g)?CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)?2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,H2的转化率一定升高
③可逆反应2SO2+O2?2SO3,当混合气体的密度一定时,反应一定达到平衡
④有气体参加的反应达平衡时,应当有V正(气)=V逆(气)=0.
查看习题详情和答案>>
下列与氯有关的说法中,正确的是( )
| A、通过化学变化可以实现35Cl与37Cl间的相互转化 | B、向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | C、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | D、电解NaCl溶液得到22.4LH2 (标准状况),理论上需要转移1mol电子 |