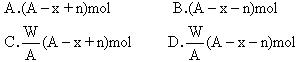摘要:元素R的一种原子.质量数为A.其阴离子Rn-有B个电子.则原子核内的中子数为( ) A.A+B+n B.A-B+n C.A-B-n D.A+B-n
网址:http://m.1010jiajiao.com/timu3_id_152509[举报]
某元素的一种同位素R具有微弱放射性,其原子核内中子数比质子数多43,由它组成的固体单质A,在一定条件下密度为6.88 g/m3,用X射线研究其固体表明,在边长为1.00×10-7 cm的立方体中含有20个原子。
R在化学反应中常表现为+2、+4价,在溶液中R2+稳定,而R4+有强氧化性,可将NO氧化为HNO3。回答:
(1)R的摩尔质量为__________。
(2)R处于周期表第__________周期__________族。
(3)将含R4+的溶液加入到Fe(NO3)2溶液中,反应的离子方程式为________________。
查看习题详情和答案>>现有A,B,C,D四种短周期主族元素,其中原子序数依次增大.已知B和D同主族.A元素的最高正价和最低负价的绝对值之差为2;1molC单质能与冷水反应,在标准状况下生成11.2LH2;D-的电子层结构与Ar原子相同.请回答下列问题:
(1)在右图塔式周期表相应位置标出A,B,C,D 四种元素的元素符号.同时在图中将过渡元素涂黑.
(2)用电子式表示B与C形成化合物的过程
 .
.
(3)图中“钾”和D形成的简单离子的半径大小为
(4)元素非金属性强弱比较有很多方法,其中A和D的非金属性强弱的研究
方案中比较可行的是
①比较两种单质的颜色 ②比较氢化物的稳定性
③比较原子半径大小 ④比较最高价氧化物对应水化物的酸性
(5)A元素能与另外三种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5.则该物质的结构式为
 .
.
查看习题详情和答案>>

(1)在右图塔式周期表相应位置标出A,B,C,D 四种元素的元素符号.同时在图中将过渡元素涂黑.
(2)用电子式表示B与C形成化合物的过程


(3)图中“钾”和D形成的简单离子的半径大小为
r(Cl-)>r(K+)
r(Cl-)>r(K+)
(用离子符号和“>”、“=”或“<”表示).(4)元素非金属性强弱比较有很多方法,其中A和D的非金属性强弱的研究
方案中比较可行的是
②④
②④
(填序号).①比较两种单质的颜色 ②比较氢化物的稳定性
③比较原子半径大小 ④比较最高价氧化物对应水化物的酸性
(5)A元素能与另外三种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5.则该物质的结构式为