摘要:24.为了证实木炭在加热条件下被浓H2SO4氧化生成的产物.选用图示仪器和所盛物质组成的整套装置.并回答下列问题 ①这套装置连接顺序(按气流从左到右填写接上字母) .说明理由 . ②实验时可观察到试置C中溶液褪色而E中不褪色.这说明 .试管D中试剂的作用是 . ③要证实反应产物中含CO2.在试管B中装 溶液.有关反应的离子方程式是 . 无色溶液a 25.有一Na2SO3晶体因部分被氧化而变质.为了测定样品中杂质的质量分数.根据下图的实验步骤进行测定.按要求填写空白 样品完全溶解 称量样品W1g 加足量水溶解 加过量HCl酸化 白色溶液b 的A并过滤溶液I 无色溶液 称为c的足量为W2g 加无色溶液B 洗涤烘干 白色溶液c 并过滤浊液II ①在用托盘天平称样品时.应先对托盘天平 . ②A的化学式为 .A必须过量的原因是 . ③确定A是否过量的方法是 . ④白色沉淀b含有 . ⑤无色溶液B通常是 . ⑥通过以上测定可得到样品中杂质的质量分数计算关系式为 .
网址:http://m.1010jiajiao.com/timu3_id_152453[举报]
某校研究性学习小组,设计如下装置来验证浓硫酸与木炭在加热条件下的产物中含有SO2和CO2.同学们查阅资料得知二氧化硫可使酸性高锰酸钾溶液褪色,化学方程式为:2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4
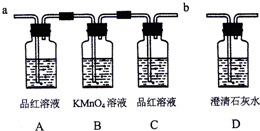
(1)实验时,反应产生的气体应从
(2)A瓶的实验现象是
(3)讨论中某同学认为两次出现品红溶液不必要,你认为
(4)要证明产物中含有CO2的实验现象是:C中品红溶液
查看习题详情和答案>>

(1)实验时,反应产生的气体应从
a
a
端通入装置.(用“a”或“b”填空)(2)A瓶的实验现象是
品红溶液褪色
品红溶液褪色
,A瓶溶液的作用是检验二氧化硫的存在
检验二氧化硫的存在
,B瓶溶液的作用是吸收二氧化硫气体
吸收二氧化硫气体
.(3)讨论中某同学认为两次出现品红溶液不必要,你认为
不能
不能
(填“能”或“不能”)去掉C瓶,C瓶溶液的作用是检验二氧化硫气体是否除净
检验二氧化硫气体是否除净
.(4)要证明产物中含有CO2的实验现象是:C中品红溶液
不褪色
不褪色
,D中澄清石灰水变浑浊
变浑浊
.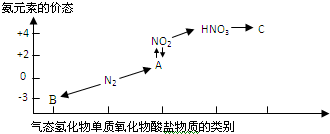 如图是氮元素的几种价态与物质类别的对应关系:
如图是氮元素的几种价态与物质类别的对应关系:回答下列问题:
(1)写出N2的一种用途
(2)从N元素化合价分析,N2具有氧化性和还原性.各举一例说明(用化学方程式表示)
氧化性
还原性
(3)HNO3与上图中的物质C常用于检验Cl-的存在,则C的化学式为
(4)实验室制取物质B的化学方程式为
(5)NO2与水反应生成物质A的化学方程式为
(6)浓硝酸与木炭在加热条件下反应的化学方程式为
 某学生为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了如图所示的实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉.请回答下列问题:
某学生为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了如图所示的实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉.请回答下列问题:(1)写出浓硫酸与木炭在加热条件下反应的化学方程式:
2H2SO4(浓)+C
2SO2↑+CO2↑+2H2O
| ||
2H2SO4(浓)+C
2SO2↑+CO2↑+2H2O
.
| ||
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是
③①②
③①②
(用操作编号填写);①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(3)实验时,装置C中的现象为
品红溶液褪色
品红溶液褪色
.(4)当装置D中产生
AD
AD
(填选项,多选不得分)现象时,可以说明使装置E中澄清石灰水变浑浊的是CO2,而不是SO2;A.进气口一端脱脂棉上蓝色变浅,出气口一端脱脂棉上蓝色不变
B.脱脂棉上蓝色均变浅
C.脱脂棉上的蓝色完全褪去
D.脱脂棉上的蓝色不变
装置D中发生反应的离子方程式是:
SO2+I2+2H2O=4H++2I-+SO42-
SO2+I2+2H2O=4H++2I-+SO42-
.
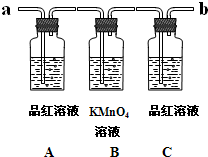 已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4
已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4