网址:http://m.1010jiajiao.com/timu3_id_152153[举报]
(1)工业上可用氯气和石灰乳为原料制造漂白粉,漂白粉为
(2)工业上生产半导体材料硅的流程如图所示:

①石英砂的主要成分是二氧化硅,在制备粗硅时,焦炭的作用是
②粗硅与氯气反应后得到沸点较低的液态四氯化硅,其中常混有一些高沸点、难挥发性杂质,必须进行分离提纯.其提纯方法为
A.蒸馏 B.过滤 C.萃取 D.蒸发
③四氯化硅与氢气在高温条件下反应得到高纯硅和氯化氢气体,写出该反应的化学方程式:
| ||
| ||
氯碱工业中,通过电解饱和食盐水获得重要的化工原料:氯气、氢气和氢氧化钠.其中氯气用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、硅、聚氯乙烯、氯苯等.
(1)工业上可用氯气和石灰乳为原料制造漂白粉,漂白粉为______(填“纯净物”或“混合物”),制备漂白粉的化学方程式为______.
(2)工业上生产半导体材料硅的流程如图所示:
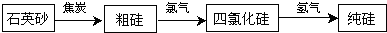
①石英砂的主要成分是二氧化硅,在制备粗硅时,焦炭的作用是______.(填“氧化剂”或“还原剂”)
②粗硅与氯气反应后得到沸点较低的液态四氯化硅,其中常混有一些高沸点、难挥发性杂质,必须进行分离提纯.其提纯方法为______.(填字母)
A.蒸馏 B.过滤 C.萃取 D.蒸发
③四氯化硅与氢气在高温条件下反应得到高纯硅和氯化氢气体,写出该反应的化学方程式:______.
查看习题详情和答案>>
(1)工业上可用氯气和石灰乳为原料制造漂白粉,漂白粉为 (填“纯净物”或“混合物”),制备漂白粉的化学方程式为 .
(2)工业上生产半导体材料硅的流程如图所示:

①石英砂的主要成分是二氧化硅,在制备粗硅时,焦炭的作用是 .(填“氧化剂”或“还原剂”)
②粗硅与氯气反应后得到沸点较低的液态四氯化硅,其中常混有一些高沸点、难挥发性杂质,必须进行分离提纯.其提纯方法为 .(填字母)
A.蒸馏 B.过滤 C.萃取 D.蒸发
③四氯化硅与氢气在高温条件下反应得到高纯硅和氯化氢气体,写出该反应的化学方程式: . 查看习题详情和答案>>
)单晶硅是信息产业中重要的基础材料。工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图。

实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4、AlCl3、FeCl3遇水均易水解,有关物质的物理常数见下表:
物质 | SiCl4 | AlCl3 | FeCl3 |
沸点/℃ | 57.7 | - | 315 |
熔点/℃ | -70.0 | - | - |
升华温度/℃ | - | 180 | 300 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:_____________, 装置D的硬质玻璃管中发生反应的化学方程式是????????????????????????? 。
(2)装置C中的试剂是?????????? ; D、E间导管短且粗的原因是????????????? 。
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-;假设3:?????? 。
【设计方案,进行实验】可供选择的实验试剂有:3 mol/L H2SO4、1 mol/L NaOH、0.01 mol/L KMnO4、溴水、淀粉-KI、品红等溶液。
取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:
序号 | 操? 作 | 可能出现的现象 | 结论 |
① | 向a试管中滴加几滴????????? 溶液 | 若溶液褪色 | 则假设1成立 |
若溶液不褪色 | 则假设2或3成立 | ||
② | 向b试管中滴加几滴????????? 溶液 | 若溶液褪色 | 则假设1或3成立 |
若溶液不褪色 | 假设2成立 | ||
③ | 向c试管中滴加几滴????????? 溶液 |
| 假设3成立 |
查看习题详情和答案>>