摘要:下边左边是污染原因.右边是污染产生的结果.试用短线将有关因果关系联系起来 氟里昂等排放物 酸雨 乱砍滥伐森林 土壤和水污染 核污染 放射病和癌症发病率增加 汽车.燃煤等排出的SO2 破坏臭氧层 大量使用农药 土地沙漠化
网址:http://m.1010jiajiao.com/timu3_id_152067[举报]
下列左边是污染原因,右边是污染产生结果,试用短线将有关因果联系起来:
①氟里昂(氟氯烃)等排放物 a.酸雨
②乱砍滥伐森林 b.土壤和水污染
③核污染 c.放射病和癌症发病率缯加
④汽车、燃煤等排SO2 d.破坏臭氧层
⑤大量使用农药 e.土地沙漠化
查看习题详情和答案>> (2012?南京模拟)己二酸是合成尼龙-66的主要原料之一.实验室用高锰酸钾氧化环己醇制己二酸的装置如图所示(加热、搅拌和仪器固定装置均已略去).实验过程如下:
(2012?南京模拟)己二酸是合成尼龙-66的主要原料之一.实验室用高锰酸钾氧化环己醇制己二酸的装置如图所示(加热、搅拌和仪器固定装置均已略去).实验过程如下:①将5mL 10% NaOH溶液、50mL水、6g KMnO4加入三颈瓶中,搅拌加热至35℃使之溶解.
②继续加热,维持反应温度45℃左右,边搅拌边缓慢滴加2.1mL环己醇,直到高锰酸钾溶液颜色褪去.再沸水浴加热5分钟使二氧化锰凝聚.
③用玻璃棒蘸一滴反应混合物到滤纸上做点滴试验,如出现紫色的环,向反应混合物中加入少量A固体直至点滴试验无紫色环为止.
④趁热抽滤混合物,滤渣用热水洗涤.
⑤滤液用小火加热蒸发使溶液浓缩至原来体积的一半,冷却后再用浓盐酸酸化至pH为2~4止.冷却析出晶体,抽滤后再重结晶得己二酸晶体a g.
高锰酸钾氧化环己醇的反应如下:
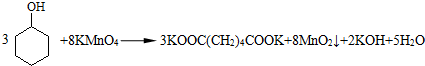
(1)步骤②中需维持反应温度45℃左右,其原因是
温度过高,反应太剧烈不易控制,且可能有副产品发生降低己二酸的产率;温度过低,反应速率太慢
温度过高,反应太剧烈不易控制,且可能有副产品发生降低己二酸的产率;温度过低,反应速率太慢
.(2)步骤③加入的固体A可能是
a
a
.a、NaHSO3 b、NaHCO3 c、NaHSO4 d、Na2SO4
(3)步骤④抽滤完毕或中途停止抽滤时,应先
先断开漏斗与安全瓶的连接,再关闭水龙头
先断开漏斗与安全瓶的连接,再关闭水龙头
.(4)步骤⑤中加浓盐酸的作用是
将己二酸的钾盐转化为己二酸
将己二酸的钾盐转化为己二酸
.(5)若要计算己二酸的产率,还需要知道的数据是
环己醇的密度
环己醇的密度
.(6)硝酸氧化环己醇也能制己二酸,与高锰酸钾相比硝酸作氧化剂的缺点是
产生氮氧化物,污染空气
产生氮氧化物,污染空气
.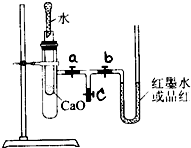 某校化学兴趣小组的同学按图所示将实验装置连接好,进行化学能与热能转化的实验探究.请帮他们回答下列问题:
某校化学兴趣小组的同学按图所示将实验装置连接好,进行化学能与热能转化的实验探究.请帮他们回答下列问题:实验前,在U型管内加入少量品红溶液(或红墨水).打开3个T型管螺旋夹,使U型管内两边的液面处于同一水平面,再夹紧螺旋夹.
(1)在内部的试管里盛1g氧化钙,当滴入2mL左右的蒸馏水后,打开a、b螺旋夹,可观察到U型管里的红墨水如何变化?
U型管里的红墨水向右移动,导致右侧液面高于左侧液面
U型管里的红墨水向右移动,导致右侧液面高于左侧液面
.(2)如果用这个装置观察到U型管内出现与上述(1)相反的现象,可在小试管中加入
NH4Cl或NH4NO3等铵盐
NH4Cl或NH4NO3等铵盐
固体后滴入适量的蒸馏水.(3)若向内部的试管中放入几小块铜片,再用滴管滴入10mL稀硝酸,能否得到(1)中现象?
能
能
,另外可观察到的现象是铜片表面有气泡冒出,过一会儿,试管口附近有红棕色气体出现,U型管里的红墨水向右移动
铜片表面有气泡冒出,过一会儿,试管口附近有红棕色气体出现,U型管里的红墨水向右移动
;产生上述现象的原因是铜片和稀硝酸反应生成NO,NO被氧气氧化为NO2;该反应放热,使大试管内气压增大,导致U型管里的红墨水向右移动
铜片和稀硝酸反应生成NO,NO被氧气氧化为NO2;该反应放热,使大试管内气压增大,导致U型管里的红墨水向右移动
;写出有关反应的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2
;由此可知,反应后产物的总能量小于
小于
(填“大于”、“小于”、“等于”)硝酸和铜片的总能量.此时该装置有明显的不足,原因是NO、NO2逸散到空气中,会造成环境污染
NO、NO2逸散到空气中,会造成环境污染
,改进的方法是在试管上加一双孔塞,用导气管将生成的气体导入到氢氧化钠溶液中
在试管上加一双孔塞,用导气管将生成的气体导入到氢氧化钠溶液中
.