摘要::SiCl4.CCl4(D),:CH4.SiH4(A)
网址:http://m.1010jiajiao.com/timu3_id_151915[举报]
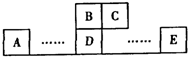 如图为元素周期表中的一部分,A、B、C、D、E均为短周期主族元素,B元素原子的最外层有4个电子,E原子最外层电子数与C的原子序数相等.回答下列问题:
如图为元素周期表中的一部分,A、B、C、D、E均为短周期主族元素,B元素原子的最外层有4个电子,E原子最外层电子数与C的原子序数相等.回答下列问题:(1)B、D形成的化合物甲,C、D形成的化合物乙,二者晶体结构均为空间网状结构,则其晶体类型为
原子晶体
原子晶体
;乙的化学式为Si3N4
Si3N4
.(2)B、D分别可与E形成化合物丙、丁,丙属于
非极性
非极性
(填“非极性”或“极性”)分子,试将甲、乙、丙、丁四种物质按熔点由高到低的顺序排列:Si3N4>SiC>SiCl4>CCl4
Si3N4>SiC>SiCl4>CCl4
.(用化学式表示)(3)B和C元素形成的物质(BC)2可称为拟卤素,写出该物质与NaOH溶液反应的离子方程式
(CN)2+2OH-=CN-+CNO-+H2O
(CN)2+2OH-=CN-+CNO-+H2O
.(4)C、E形成的分子的空间构型为三角锥形,分子中各原子最外层均达8电子稳定结构,该物质在潮湿的空气中与水蒸气能发生氧化还原反应,生成含C的无色氧化物气体、C的最高价含氧酸及E的氢化物,写出该反应的化学方程式
3NCl3+5H2O=2NO+HNO3+9HCl
3NCl3+5H2O=2NO+HNO3+9HCl
. (2013?江苏)A.[物质结构与性质]
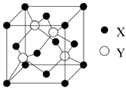
(2013?江苏)A.[物质结构与性质]元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.
(1)X与Y所形成化合物晶体的晶胞如右图所示.
①在1个晶胞中,X离子的数目为
4
4
.②该化合物的化学式为
ZnS
ZnS
.(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是
sp3
sp3
.(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是
水分子与乙醇分子之间形成氢键
水分子与乙醇分子之间形成氢键
.(4)Y 与Z 可形成YZ42-
①YZ42-的空间构型为
正四面体
正四面体
(用文字描述).②写出一种与YZ42-互为等电子体的分子的化学式:
CCl4或SiCl4等
CCl4或SiCl4等
.(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为
16NA
16NA
.