网址:http://m.1010jiajiao.com/timu3_id_151764[举报]
(12分)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中发生了氧化还原反应的是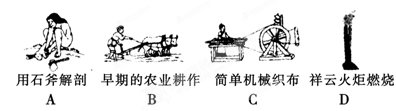
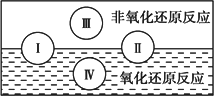
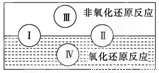
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。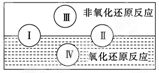
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
其中水为________剂。
(3)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为__________________________。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
________Cu2S+________Fe3++______H2O________Cu2++________Fe2++________( )+________SO42-。
(4)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是 。
(12分)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中发生了氧化还原反应的是
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
其中水为________剂。
(3)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为__________________________。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
________Cu2S+________Fe3++______H2O________Cu2++________Fe2++________( )+________SO42-。
(4)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是 。
查看习题详情和答案>>
(1)下列生产、生活中的事例中发生了氧化还原反应的是
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
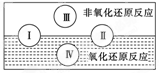
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
其中水为________剂。
(3)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为__________________________。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
________Cu2S+________Fe3++______H2O________Cu2++________Fe2++________( )+________SO42-。
(4)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是 。
| |||||||||||||||||||||||||
(10分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中C02的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)下列关于C02的用途不正确的是 (填序号)。
A.二氧化碳能溶于水,可用于生产碳酸型饮料
B.固体二氧化碳俗称干冰,可用于人工降雨
C.二氧化碳用于灭火是因为降低了可燃物的着火点
D.超临界二氧化碳作萃取溶剂用于从天然产物提取和净化活性组分
E.二氧化碳可以作为气肥,提高农作物的产量
(2)目前工业上有一种方法是用C02来生产甲醇。为探究其反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:C02(g)+
3 H2(g) ![]() CH30H(g)+H20(g) ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。
CH30H(g)+H20(g) ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率:v(H。)= 。
②该反应的平衡常数为 。
(3)以KHC03溶液为电解质,用电解的方法也可以将C02还原为甲醇。请写出电解时阴极的离子方程式:
(4)金刚石、石墨烯、线型碳是碳的几种同素异形体。从键的类型分析它们的稳定性由强到弱的顺序为
查看习题详情和答案>>