网址:http://m.1010jiajiao.com/timu3_id_151490[举报]
为了除去混在CO2气体中的SO2和O2,下列试剂的使用顺序正确的是
①饱和Na2CO3溶液
②饱和NaHCO3溶液
③浓H2SO4
④灼热的铜网
⑤碱石灰
[ ]
(1)汽车尾气主要含有CO2、CO、SO2、NO及汽油、柴油等物质,这种尾气越来越成为城市空气污染的主要来源。汽车尾气中的CO来自_________,NO来自_________。
(2)空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应。下列有关说法正确的是_________。
A.停止使用氟里昂是为了保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾一淀粉试纸变蓝
(3)一定条件下,2SO2(g)+O2(g)
 2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol
2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=________。
(4)在一定条件下用氨可将氮氧化物转化为无毒气体。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,原混合气体中NO和NO2的体积比是_________。
(5)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能将工业废 气中的酸性氧化物分解除去,转化流程如图所示。若2 mol ZnFe2Ox与SO2反应可生成0.75 mol S,则x=
__________。

(16分)碳及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化SO2被还原为S。
已知: C(s)+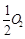 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ①
C(s)+O2(g)=CO2(g) ΔH2= -393.5kJ·mol-1 ②
S(s)+O2(g)=SO2(g) ΔH3= -296.8kJ·mol-1 ③
则SO2氧化CO的热化学反应方程式:
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。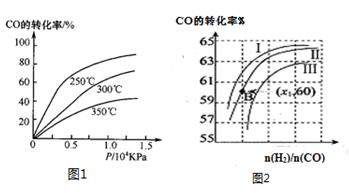
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应ΔH 0(填“>”或“ <”)。
图2表示CO的转化率与起始投料比[ n(H2)/n(CO)]、温度的变化关系,曲线I、II、III对应的平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为 ;测得B(X1,60)点氢气的转化率为40%,则x1= 。
②在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 (填序号)。
| A.正反应速率先增大后减小 | B.逆反应速率先增大后减小 |
| C.化学平衡常数K值增大 | D.反应物的体积百分含量增大 |
③一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K= 。
(3)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。
原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O
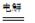 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如图所示:
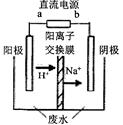
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为:
4OH--4e-═O2↑+2H2O; 。
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入1m3乙醛的含量为300mg/L的废水,可得到乙醇 kg(计算结果保留2位小数) 查看习题详情和答案>>
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化SO2被还原为S。
已知: C(s)+
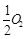 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ①C(s)+O2(g)=CO2(g) ΔH2= -393.5kJ·mol-1 ②
S(s)+O2(g)=SO2(g) ΔH3= -296.8kJ·mol-1 ③
则SO2氧化CO的热化学反应方程式:
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应ΔH 0(填“>”或“ <”)。
图2表示CO的转化率与起始投料比[ n(H2)/n(CO)]、温度的变化关系,曲线I、II、III对应的平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为 ;测得B(X1,60)点氢气的转化率为40%,则x1= 。
②在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 (填序号)。
| A.正反应速率先增大后减小 | B.逆反应速率先增大后减小 |
| C.化学平衡常数K值增大 | D.反应物的体积百分含量增大 |
③一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K= 。
(3)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。
原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O
 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如图所示:

①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为:
4OH--4e-═O2↑+2H2O; 。
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入1m3乙醛的含量为300mg/L的废水,可得到乙醇 kg(计算结果保留2位小数)
Ⅰ.沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是可持续发展的重要保证。
 (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式???????????????????????????????? 。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式???????????????????????????????? 。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入?????????? (选填“Na2S”或“NaOH”)效果更好。
难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
(3)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:

①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因????????? (任写一个)。
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示。

请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:??? 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是?????????????????? (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是???????????????????????? 。
Ⅱ.能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式
①2H2(g)+O2(g)=2H2O(l)????  H=-570kJ/mol;
H=-570kJ/mol;
②H2(g)+1/2O2(g)=H2O(g)???  H=-242kJ/mol;
H=-242kJ/mol;
③C(s)+1/2O2(g)=CO(g)????  H=—110.5kJ/moL;
H=—110.5kJ/moL;
④C(s)+O2(g)=CO2(g)???????  H=—393.5kJ/moL;
H=—393.5kJ/moL;
⑤CO2(g)+2H2O(g)=2CH4(g)+2 O2(g)?  H=+890kJ/moL
H=+890kJ/moL
回答下列问题
(1)上述反应中属于吸热反应的是??????????????? 。
(2)H2的燃烧热为△H=??????????????? 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)=H2(g)+ CO(g)????  H=akJ/moL;则a=???????? ;该反应的熵
H=akJ/moL;则a=???????? ;该反应的熵 S???????? 0(选填“>”、“=”、“<”);已知自由能
S???????? 0(选填“>”、“=”、“<”);已知自由能 G=
G= H—T
H—T S,当
S,当 G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
(4)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是????? 。

A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2—由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
查看习题详情和答案>>