摘要:工业上可以CO2.NH3.H2O和NaCl为原料来生产两种固体化工产品.已知:CO2 + NH3 + H2O = NH4HCO3.且在一定温度下.NH4Cl.NaCl.NH4HCO3和NaHCO3的溶解度存在着这样一种关系: NaCl > NH4Cl > NH4HCO3 > NaHCO3.据此可分析得知.该两种固体化工产品分别为 和 .其中.前者是通过 加热得到的.后者可作化学肥料.
网址:http://m.1010jiajiao.com/timu3_id_151334[举报]
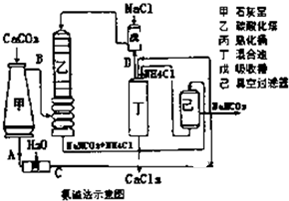 (2013?淄博一模)工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱.请回答下列问题:
(2013?淄博一模)工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱.请回答下列问题:(1)卢布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱.硫酸钠和焦炭、石灰石反应的化学方程式为
Na2SO4+4C+CaCO3
CaS+Na2CO3+4CO
或Na2SO4+2C+CaCO3
CaS+Na2CO3+2CO2
| ||
或Na2SO4+2C+CaCO3
| ||
Na2SO4+4C+CaCO3
CaS+Na2CO3+4CO
或Na2SO4+2C+CaCO3
CaS+Na2CO3+2CO2
(已知产物之一为CaS).
| ||
或Na2SO4+2C+CaCO3
| ||
(2)氨碱法的工艺如图所示,得到的碳酸氢钠经煅烧生成纯碱.
①图中的中间产物C是
Ca(OH)2
Ca(OH)2
,DNH3
NH3
(写化学式).②装置乙中发生反应的化学方程式为
NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl
NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl
.NaCl是一种化工原料,可以制备一系列物质(反应条件、部分反应物质已略去),它们的转化关系如图所示,请回答下列问题:

(1)工业上常用电解熔融NaCl的方法制取金属钠,NaCl熔化时破坏离子键的过程属于
(2)写出工业上制取HCl的化学方程式
(3)写出工业上制取烧碱的离子方程式
(4)氨碱法制纯碱的工艺流程为:

由NaHCO3制取Na2CO3的化学方程式
(5)请你设计一实验证明Na2CO3溶液碱性比NaHCO3溶液的碱性强:
查看习题详情和答案>>

(1)工业上常用电解熔融NaCl的方法制取金属钠,NaCl熔化时破坏离子键的过程属于
物理变化
物理变化
(填“物理变化”或“化学变化”).(2)写出工业上制取HCl的化学方程式
H2+Cl2
2HCl
| ||
H2+Cl2
2HCl
.
| ||
(3)写出工业上制取烧碱的离子方程式
2Cl-+2H2O
2OH-+H2↑+Cl2↑
| ||
2Cl-+2H2O
2OH-+H2↑+Cl2↑
.
| ||
(4)氨碱法制纯碱的工艺流程为:

由NaHCO3制取Na2CO3的化学方程式
2NaHCO3
Na2CO3+CO2↑+H2O
| ||
2NaHCO3
Na2CO3+CO2↑+H2O
.工艺流程中无向饱和食盐水中通入NH3(再通入CO2)的目的是:
| ||
因为NH3极易溶于水且溶液呈弱减性,再通入CO2使之更多地转化为HCO3-
因为NH3极易溶于水且溶液呈弱减性,再通入CO2使之更多地转化为HCO3-
.(5)请你设计一实验证明Na2CO3溶液碱性比NaHCO3溶液的碱性强:
配制 0.1mol?L-1(或等物质的量浓度)的两种溶液,则其pH,Na2CO3溶液pH大于NaHCO3溶液,说明Na2CO3溶液碱性比NaHCO3溶液的碱性强
配制 0.1mol?L-1(或等物质的量浓度)的两种溶液,则其pH,Na2CO3溶液pH大于NaHCO3溶液,说明Na2CO3溶液碱性比NaHCO3溶液的碱性强
.海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图是工业上对海水的几项综合利用的示意图:
回答下列问题:
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液.加入试剂的顺序是
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱.
①气体A、B是CO2或NH3,则气体A应是
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品
NH4Cl晶体,则通入NH3的作用是
(3)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.
a、写出步骤①④反应的离子方程式:①
b、在步骤⑥的蒸馏过程中,温度应控制在80-90℃、温度过高过低都不利于生产,请解释原因:
c、在步骤①、②之后并未直接用“含溴的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是
查看习题详情和答案>>

回答下列问题:
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液.加入试剂的顺序是
CBDA或BCDA
CBDA或BCDA
.②电解饱和食盐水时,与电源正极相连的电极上发生的反应为
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
,与电源负极线连的电极附近溶液pH变大
变大
(变大、不变、变小).(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱.
①气体A、B是CO2或NH3,则气体A应是
NH3
NH3
(填化学式).C的制得发生反应的化学方程式为2NaHCO3
Na2CO3+CO2↑+H2O
| ||
2NaHCO3
Na2CO3+CO2↑+H2O
.
| ||
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品
NH4Cl晶体,则通入NH3的作用是
氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
.(3)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.
a、写出步骤①④反应的离子方程式:①
2Br-+Cl2=2Cl-+Br2
2Br-+Cl2=2Cl-+Br2
;④SO2+Br2+2H2O=2HBr+H2SO4
SO2+Br2+2H2O=2HBr+H2SO4
.b、在步骤⑥的蒸馏过程中,温度应控制在80-90℃、温度过高过低都不利于生产,请解释原因:
温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
.c、在步骤①、②之后并未直接用“含溴的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是
“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低.
“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低.
.工业上对海水资源综合开发利用的部分工艺流程如图1所示.
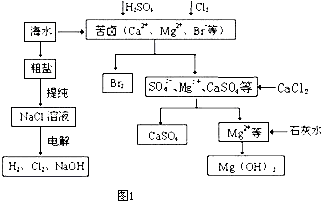
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,粗制后可得饱和NaCl溶液,精制时通常在溶液中依次中加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性.请写出加入Na2CO3溶液后相关化学反应的离子方程式:
(2)本工艺流程中先后制得Br2、CaSO4、Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?
(3)氯化钠是重要的氯碱工业化工的原料.电解饱和食盐水常用离子膜电解槽和隔膜电解槽.离子膜和隔膜均允许通过的分子或离子是
A.Cl- B.Na+ C.OH- D.Cl2
(4)饱和食盐水电解时与电源正极相连的电极上发生的反应为
(5)氯化钠的可用于生产纯碱,我国化学家侯德榜改革国外生产工艺,生产流程简要表示如图2:
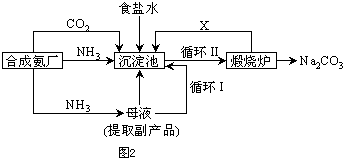
①上述生产纯碱的方法称
写出上述流程中X物质的分子式
②合成氨原料气中氮气制备的方法之一为
③沉淀池中发生的化学反应方程式是
④为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加
查看习题详情和答案>>

(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,粗制后可得饱和NaCl溶液,精制时通常在溶液中依次中加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性.请写出加入Na2CO3溶液后相关化学反应的离子方程式:
Ba2++CO32-=BaCO3↓;Ca2++CO32-=CaCO3↓;
Ba2++CO32-=BaCO3↓;Ca2++CO32-=CaCO3↓;
.(2)本工艺流程中先后制得Br2、CaSO4、Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?
否
否
(填“能”或“否”),原因是如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯
如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯
.(3)氯化钠是重要的氯碱工业化工的原料.电解饱和食盐水常用离子膜电解槽和隔膜电解槽.离子膜和隔膜均允许通过的分子或离子是
B
B
.A.Cl- B.Na+ C.OH- D.Cl2
(4)饱和食盐水电解时与电源正极相连的电极上发生的反应为
氧化反应,2Cl--2e-=Cl2↑
氧化反应,2Cl--2e-=Cl2↑
,与电源负极线连的电极附近溶液pH变大
变大
(变大、不变、变小).(5)氯化钠的可用于生产纯碱,我国化学家侯德榜改革国外生产工艺,生产流程简要表示如图2:

①上述生产纯碱的方法称
联合制碱法
联合制碱法
,副产品的一种用途为做化肥
做化肥
.写出上述流程中X物质的分子式
CO2
CO2
.使原料氯化钠的利用率从70%提高到90%以上,主要是设计了Ⅰ
Ⅰ
(填上述流程中的编号)的循环.从沉淀池中取出沉淀的操作是过滤
过滤
.②合成氨原料气中氮气制备的方法之一为
液态空气依据沸点分离
液态空气依据沸点分离
,另一原料气氢气的制取化学方程式为C+H2O
CO+H2,CO+H2O
CO2+H2
| ||
| ||
C+H2O
CO+H2,CO+H2O
CO2+H2
.
| ||
| ||
③沉淀池中发生的化学反应方程式是
NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓
NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓
.要实现该反应,你认为应该如何操作:向氨化的饱和氯化钠溶液中通入二氧化碳气体得到碳酸氢钠晶体
向氨化的饱和氯化钠溶液中通入二氧化碳气体得到碳酸氢钠晶体
;④为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加
用硝酸酸化的硝酸银,观察产生白色沉淀
用硝酸酸化的硝酸银,观察产生白色沉淀
.化学反应中一定伴随着能量的变化,化学能在实际生产生活中的应用将越来越广泛。
(1)利用氢气可以制取工业原料乙酸。已知:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1 = -870.3kJ/mo1
②C(s)+O2(g)=CO2(g) △H 2= -393.5kJ/mo1
③H2(g) + 1/2O2(g)=H2O(l) △H 3= -285.8kJ/mo1
试利用上述信息计算下述反应的反应热:
2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H= 。
(2)科学家可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后熵增的为 (填字母)。
A.2Na+2H2O=2NaOH+H2↑ B.3Fe+2O2=Fe3O4
C.(NH4)2CO3=NH4HCO3+NH3↑ D.NaOH+HCl=NaCl+H2O
(3)实验室可以利用下图装置进行中和热测定。回答下列问题:

①请指出该装置还缺少的仪器是 ;
②两烧杯间填满碎泡沫塑料的作用是 ;
③若向三份等体积、等物质的量浓度的NaOH溶液中分别加入稀醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。则三者的大小关系是 (由大到小)。
查看习题详情和答案>>