网址:http://m.1010jiajiao.com/timu3_id_151127[举报]
在量热计中(如图)将100 mL 0.50 mol·L-1的CH3COOH溶液与100 mL 0.55 mol·L-1的NaOH溶液混合,温度从298.0 K升高至300.7 K。已知量热计的热容常数(量热计各部件每升高1 K所需要热量)是150.5 J·K-1,溶液密度均为1 g·mL-1,生成溶液的比热容c=4.184 J·(g·K)-1。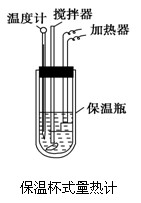
(1).试求CH3COOH的中和热ΔH表达数值式。
(2).上述数值结果与57.3 kJ/mol有偏差,产生原因可能是
a.实验装置保温、隔热效果差
b.配制0.55 mol/L NaOH溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
e.用量筒量取NaOH溶液的体积时仰视读数
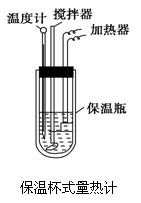
(1).试求CH3COOH的中和热ΔH表达数值式。
(2).上述数值结果与57.3 kJ/mol有偏差,产生原因可能是
a.实验装置保温、隔热效果差
b.配制0.55 mol/L NaOH溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
e.用量筒量取NaOH溶液的体积时仰视读数
(1)将含有等物质的量的NaHSO4和Ba(OH)2溶液混合:Ba2+ +2OH-+2H++SO42-==BaSO4↓+ 2 H2O
(2)向碳酸氢钠溶液中加入过量澄清石灰水:Ca2++2OH-+2 HCO3-==CaCO3↓+2 H2O+ CO32-
(3)用0.2 mol · L-1的H2S溶液100 mL与0.1 mol · L-1 NaOH溶液300 mL 反应:H2S+2OH-= S2-+2H2O
(1) ;
(2) ;
(3) 。
查看习题详情和答案>>
(1)将含有等物质的量的NaHSO4和Ba(OH)2溶液混合:Ba2+ +2OH-+2H++SO![]() ==BaSO4↓+
2 H2O
==BaSO4↓+
2 H2O
(2)向碳酸氢钠溶液中加入过量澄清石灰水:Ca2++2OH-+2 HCO![]() ==CaCO3↓+2
H2O+ CO
==CaCO3↓+2
H2O+ CO![]()
(3)用0.2 mol · L-1的H2S溶液100 mL与0.1 mol · L-1 NaOH溶液300 mL 反应:H2S+2OH-= S2-+2H2O
(1) ;
(2) ;
(3) 。
查看习题详情和答案>>
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H =
在量热计中(如图)将100 mL 0.50 mol/L的CH3COOH溶液与100 mL 0.55 mol/L NaOH溶液混合,温度从298.0 K升高到300.7 K.已知量热计的热容常数(量热计各部件每升高1 K所需要的热量)是150.5 J/K,溶液密度均为1 g/mL,生成溶液的比热容c=4.184 J/(g·K).
(2) CH3COOH的中和热ΔH=_______________________________.
(3)CH3COOH的中和热的文献值为-56.1 kJ/mol,你认为(1)中测得的实验值偏差可能的原因是(填二点)____________________________________________