摘要:0.1mol.L-1
网址:http://m.1010jiajiao.com/timu3_id_150689[举报]
(1)一定温度下,向某容积固定的容器中加入NH4I固体,发生如下反应:
①NH4I(s)?NH3(g)+HI(g) ②2HI(g)?H2(g)+I2(g)
达到平衡时测得HI和H2物质的量浓度分别为4mol?L-1和1mol?L-1.则反应①的化学平衡常数K= .
(2)实验室用Zn和稀硫酸反应制取H2,反应过程中水的电离平衡 移 动(填“向左”、“向右”或“不”).
动(填“向左”、“向右”或“不”).
(3)Cu与稀硫酸不能自发反应产生H2,为了使反应2H++Cu═Cu2++H2↑能进行,请设计一个合适的实验方案,在方框中画出实验装置图(不书写方案,只要求画出装置图).
(4)近年来,在化学电源的研究方面取得了一些重要成果,燃料电池就是其中一项.已知2.3g液态乙醇在室温时完全燃烧放出的热量为68.4kJ,则该条件下乙醇燃烧的热化学方程式为 .若将乙醇的燃烧反应设计成原电池装置,能量的利用率会更高,当电解质溶液为氢氧化钾溶液时,负极的电极反应式为.
(5)室温时,在0.10mol?L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)= mol?L-1(室温时Ksp[Cu(OH)2]=2.2×10-20).
查看习题详情和答案>>
①NH4I(s)?NH3(g)+HI(g) ②2HI(g)?H2(g)+I2(g)
达到平衡时测得HI和H2物质的量浓度分别为4mol?L-1和1mol?L-1.则反应①的化学平衡常数K=
(2)实验室用Zn和稀硫酸反应制取H2,反应过程中水的电离平衡
 动(填“向左”、“向右”或“不”).
动(填“向左”、“向右”或“不”).(3)Cu与稀硫酸不能自发反应产生H2,为了使反应2H++Cu═Cu2++H2↑能进行,请设计一个合适的实验方案,在方框中画出实验装置图(不书写方案,只要求画出装置图).
(4)近年来,在化学电源的研究方面取得了一些重要成果,燃料电池就是其中一项.已知2.3g液态乙醇在室温时完全燃烧放出的热量为68.4kJ,则该条件下乙醇燃烧的热化学方程式为
(5)室温时,在0.10mol?L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=
某有机物的结构简式为
(1)1mol该有机物与NaOH反应,要消耗
(2)1mol该有机物与Na反应,要消耗
(3)1mol该有机物与NaHCO3反应,要消耗
查看习题详情和答案>>

(1)1mol该有机物与NaOH反应,要消耗
2
2
mol的NaOH(2)1mol该有机物与Na反应,要消耗
3
3
mol的Na(3)1mol该有机物与NaHCO3反应,要消耗
1
1
mol的NaHCO3.在下列事实中,什么因素影响了化学反应速率:
(1)1mol/l和0.1mol/l的HCL分别和锌反应:
(2)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体:
(3)夏天的食品易霉变,而冬天不易发生该现象:
查看习题详情和答案>>
(1)1mol/l和0.1mol/l的HCL分别和锌反应:
浓度
浓度
.(2)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体:
催化剂
催化剂
.(3)夏天的食品易霉变,而冬天不易发生该现象:
温度
温度
.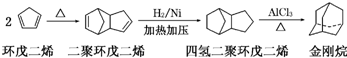
 +Br2→
+Br2→ 或
或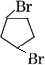
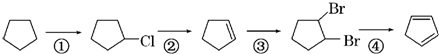
 +Cl2
+Cl2