��Ŀ����
��1��һ���¶��£���ij�ݻ��̶��������м���NH4I���壬�������·�Ӧ��
��NH4I��s��?NH3��g��+HI��g�� ��2HI��g��?H2��g��+I2��g��
�ﵽƽ��ʱ���HI��H2���ʵ���Ũ�ȷֱ�Ϊ4mol?L-1��1mol?L-1����Ӧ�ٵĻ�ѧƽ�ⳣ��K= ��
��2��ʵ������Zn��ϡ���ᷴӦ��ȡH2����Ӧ������ˮ�ĵ���ƽ�� �� ��������������ҡ���������
��������������ҡ���������
��3��Cu��ϡ������Է���Ӧ����H2��Ϊ��ʹ��Ӧ2H++Cu�TCu2++H2���ܽ��У������һ�����ʵ�ʵ�鷽�����ڷ����л���ʵ��װ��ͼ������д������ֻҪ��װ��ͼ����
��4�����������ڻ�ѧ��Դ���о�����ȡ����һЩ��Ҫ�ɹ���ȼ�ϵ�ؾ�������һ���֪2.3gҺ̬�Ҵ�������ʱ��ȫȼ�շų�������Ϊ68.4kJ������������Ҵ�ȼ�յ��Ȼ�ѧ����ʽΪ �������Ҵ���ȼ�շ�Ӧ��Ƴ�ԭ���װ�ã������������ʻ���ߣ����������ҺΪ����������Һʱ�������ĵ缫��ӦʽΪ��
��5������ʱ����0.10mol?L-1����ͭ��Һ�м�����������ϡ��Һ��ֽ�����dz��ɫ������ͭ�������ɣ�����Һ��pH=8ʱ��c��Cu2+��= mol?L-1������ʱKsp[Cu��OH��2]=2.2��10-20����
��NH4I��s��?NH3��g��+HI��g�� ��2HI��g��?H2��g��+I2��g��
�ﵽƽ��ʱ���HI��H2���ʵ���Ũ�ȷֱ�Ϊ4mol?L-1��1mol?L-1����Ӧ�ٵĻ�ѧƽ�ⳣ��K=
��2��ʵ������Zn��ϡ���ᷴӦ��ȡH2����Ӧ������ˮ�ĵ���ƽ��
 ��������������ҡ���������
��������������ҡ�����������3��Cu��ϡ������Է���Ӧ����H2��Ϊ��ʹ��Ӧ2H++Cu�TCu2++H2���ܽ��У������һ�����ʵ�ʵ�鷽�����ڷ����л���ʵ��װ��ͼ������д������ֻҪ��װ��ͼ����
��4�����������ڻ�ѧ��Դ���о�����ȡ����һЩ��Ҫ�ɹ���ȼ�ϵ�ؾ�������һ���֪2.3gҺ̬�Ҵ�������ʱ��ȫȼ�շų�������Ϊ68.4kJ������������Ҵ�ȼ�յ��Ȼ�ѧ����ʽΪ
��5������ʱ����0.10mol?L-1����ͭ��Һ�м�����������ϡ��Һ��ֽ�����dz��ɫ������ͭ�������ɣ�����Һ��pH=8ʱ��c��Cu2+��=
��������1����Ӧ�ٵ�ƽ�ⳣ��k=c��NH3��?c��HI����NH4I�ֽ����ɵ�HIΪƽ��ʱHI��ֽ��HI֮�ͣ���ΪNH4I�ֽ����ɵ�NH3���ɷ�Ӧ�ڿ�֪�ֽ��c��HI��Ϊƽ��ʱc��H2����2�������ΪNH4I�ֽ����ɵ�NH3�����뷴Ӧ�ٵ�ƽ�ⳣ��K=c��NH3��?c��HI�����㣻
��2������������������Ũ�ȼ�С����ˮ�ĵ������Ƴ̶ȼ�С��ˮ�ĵ���������У�
��3��ͭ��ϡ�����Ӧ���Ƿ��Է����еķ�Ӧ��ͨ����Ƴɵ��أ�ͭ���������������������Һ����ʵ��ͭ��ϡ����ķ�Ӧ��
��4��2.3gҺ̬�Ҵ�������ʱ��ȫȼ�շų�������Ϊ68.4kJ������46g�Ҵ�ȼ�����ɶ�����̼��Һ̬ˮ���ȣ������Ȼ�ѧ����ʽ����д����д���Ȼ�ѧ����ʽ�����Ҵ���ȼ�շ�Ӧ��Ƴ�ԭ���װ�ã�ȼ����ԭ��صĸ����Ϸ���������Ӧ�����������ҺΪ����������Һʱ��Ӧ����̼���Σ����ݵ����غ�͵���غ�д���缫��Ӧ��
��5�����ݳ����ܽ�ƽ���е��ܶȻ��������㣮
��2������������������Ũ�ȼ�С����ˮ�ĵ������Ƴ̶ȼ�С��ˮ�ĵ���������У�
��3��ͭ��ϡ�����Ӧ���Ƿ��Է����еķ�Ӧ��ͨ����Ƴɵ��أ�ͭ���������������������Һ����ʵ��ͭ��ϡ����ķ�Ӧ��
��4��2.3gҺ̬�Ҵ�������ʱ��ȫȼ�շų�������Ϊ68.4kJ������46g�Ҵ�ȼ�����ɶ�����̼��Һ̬ˮ���ȣ������Ȼ�ѧ����ʽ����д����д���Ȼ�ѧ����ʽ�����Ҵ���ȼ�շ�Ӧ��Ƴ�ԭ���װ�ã�ȼ����ԭ��صĸ����Ϸ���������Ӧ�����������ҺΪ����������Һʱ��Ӧ����̼���Σ����ݵ����غ�͵���غ�д���缫��Ӧ��
��5�����ݳ����ܽ�ƽ���е��ܶȻ��������㣮
����⣺��1��ƽ��ʱc��HI��=4mol?L-1��HI�ֽ����ɵ�H2��Ũ��Ϊ1mol?L-1����
NH4I�ֽ����ɵ�HI��Ũ��Ϊ4mol?L-1+2��1mol?L-1=6mol?L-1��
����NH4I�ֽ����ɵ�NH3��Ũ��Ϊ6mol?L-1��
���Է�Ӧ�ٵ�ƽ�ⳣ��k=c��NH3��?c��HI��=6mol?L-1��4mol?L-1=24mol2?L-2��
�ʴ�Ϊ��24mol2?L-2��
��2��ʵ������Zn��ϡ���ᷴӦ��ȡH2����Ӧ������������Ũ�ȼ�С����ˮ�����Ƴ̶ȼ�С��ˮ�ĵ���ƽ�������ƶ���
�ʴ�Ϊ�����ң�
��3��ͭ��ϡ�����Ӧ���Ƿ��Է����еķ�Ӧ��ͨ����Ƴɵ��أ�ͭ���������������������Һ����ʵ��ͭ��ϡ����ķ�Ӧ��װ����ͼ��ʾ��
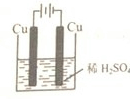 ��
��
�ʴ�Ϊ�� ��
��
��4��2.3gҺ̬�Ҵ�������ʱ��ȫȼ�շų�������Ϊ68.4kJ������46g�Ҵ�ȼ�����ɶ�����̼��Һ̬ˮ����Ϊ1368KJ/mol���Ȼ�ѧ����ʽΪ��CH3CH2OH��l��+3O2��g��=2CO2��g��+3H2O��l����H=-1368KJ/mol�����Ҵ���ȼ�շ�Ӧ��Ƴ�ԭ���װ�ã�ȼ����ԭ��صĸ����Ϸ���������Ӧ�����������ҺΪ����������Һʱ��Ӧ����̼���Σ����ݵ����غ�͵���غ�д���缫��ӦΪ��CH3CH2OH-12e-+16OH-=2CO32-+11H2O��
�ʴ�Ϊ��CH3CH2OH��l��+3O2��g��=2CO2��g��+3H2O��l����H=-1368KJ/mol��CH3CH2OH-12e-+16OH-=2CO32-+11H2O��
��5������ʱ����0.10mol?L-1����ͭ��Һ�м�����������ϡ��Һ��ֽ�����dz��ɫ������ͭ�������ɣ�����Һ��pH=8ʱ������ʱKsp[Cu��OH��2]=c��Cu2+����c2��OH-��=2.2��10-20������Һ��pH=8ʱc��OH-��=10-6mol/L��c��Cu2+��=2.2��10-8mol/L��
�ʴ�Ϊ��2.2��10-8mol/L��
NH4I�ֽ����ɵ�HI��Ũ��Ϊ4mol?L-1+2��1mol?L-1=6mol?L-1��
����NH4I�ֽ����ɵ�NH3��Ũ��Ϊ6mol?L-1��
���Է�Ӧ�ٵ�ƽ�ⳣ��k=c��NH3��?c��HI��=6mol?L-1��4mol?L-1=24mol2?L-2��
�ʴ�Ϊ��24mol2?L-2��
��2��ʵ������Zn��ϡ���ᷴӦ��ȡH2����Ӧ������������Ũ�ȼ�С����ˮ�����Ƴ̶ȼ�С��ˮ�ĵ���ƽ�������ƶ���
�ʴ�Ϊ�����ң�
��3��ͭ��ϡ�����Ӧ���Ƿ��Է����еķ�Ӧ��ͨ����Ƴɵ��أ�ͭ���������������������Һ����ʵ��ͭ��ϡ����ķ�Ӧ��װ����ͼ��ʾ��
 ��
���ʴ�Ϊ��
 ��
����4��2.3gҺ̬�Ҵ�������ʱ��ȫȼ�շų�������Ϊ68.4kJ������46g�Ҵ�ȼ�����ɶ�����̼��Һ̬ˮ����Ϊ1368KJ/mol���Ȼ�ѧ����ʽΪ��CH3CH2OH��l��+3O2��g��=2CO2��g��+3H2O��l����H=-1368KJ/mol�����Ҵ���ȼ�շ�Ӧ��Ƴ�ԭ���װ�ã�ȼ����ԭ��صĸ����Ϸ���������Ӧ�����������ҺΪ����������Һʱ��Ӧ����̼���Σ����ݵ����غ�͵���غ�д���缫��ӦΪ��CH3CH2OH-12e-+16OH-=2CO32-+11H2O��
�ʴ�Ϊ��CH3CH2OH��l��+3O2��g��=2CO2��g��+3H2O��l����H=-1368KJ/mol��CH3CH2OH-12e-+16OH-=2CO32-+11H2O��
��5������ʱ����0.10mol?L-1����ͭ��Һ�м�����������ϡ��Һ��ֽ�����dz��ɫ������ͭ�������ɣ�����Һ��pH=8ʱ������ʱKsp[Cu��OH��2]=c��Cu2+����c2��OH-��=2.2��10-20������Һ��pH=8ʱc��OH-��=10-6mol/L��c��Cu2+��=2.2��10-8mol/L��
�ʴ�Ϊ��2.2��10-8mol/L��
���������⿼�黯ѧƽ�ⳣ���ļ��㣬����ؼ�����ƽ��ʱHIΪNH4I�ֽ����ɵ�HI��ֽ��HI֮�ԭ��ء�����ԭ���ķ���Ӧ�ã��Ȼ�ѧ����ʽ��д�������ܽ�ƽ����ܶȻ��������㣬��Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
 ��2011?����ģ�⣩һ�������������Ժ�CO2������Ӧ��
��2011?����ģ�⣩һ�������������Ժ�CO2������Ӧ�� FeO��s��+CO��g������H��0
FeO��s��+CO��g������H��0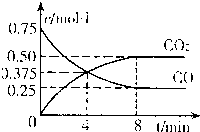 ��2010?Ϋ��һģ����Ԫ�ؼ��仯�������������������ϢϢ��أ�
��2010?Ϋ��һģ����Ԫ�ؼ��仯�������������������ϢϢ��أ�