摘要:“十一 •五 期间.全国许多地方启动的“蓝天工程 和“绿水工程 是保护生态环境.提高人类生存质量的一种很重要举措.下列措施不利于以上两项工程实施的是 A.推广使用燃煤脱硫技术.防治SO2污染 B.减少重金属.农药和难分解有机物等排放. C.加大石油.煤炭的开采速度.增加化石燃料的供应量 D.开发新能源和新致冷剂.减少CO2和氟氯烃等物质的大量排放
网址:http://m.1010jiajiao.com/timu3_id_150267[举报]
国家环保总局“环境监测公报”中指出,减少SO2等有害气体的排放和生活废水的处理是我国“十一五”期间环境保护的主要任务.保护我们赖以生存的环境应该成为我们每个人的自觉行动.下面是一些有关大气污染及治理的问题,请回答相关的内容:
(1)分析某地几年内的降雨成分发现,前些年雨水中阴离子主要以SO2-4离子为主,近几年雨水中
离子的比例有呈明显上升的趋势.通过该地的雨水样本分析,推测该地的大气污染特征是 .
A.煤烟型
B.机动车尾气型
C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
(2)某校研究性学习小组收集到一酸雨样本,他们将样本置于敞口容器中并对样本进行一段时间的pH值测定,其测定结果见下表:
请用化学方程式表示该地区酸雨pH随时间增加而减小的原因 .
(3)在工业上采用氨法烟气脱硫技术.其做法是用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合手中通入适量的氨气得到一种复合肥.氨水吸收SO2生成亚硫酸铵的化学方程式 .
(4)为将SO2的污染变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2和得到单质硫.该方法涉及到的化学反应有:
A.XSO2+2XCO═2xCO2+Sx
B.xCO+Sx═xCOS
C.2XCOS+xSO2═2xCO2+3Sx
其中属于氧化还原反应的是 (填字母).COS分子的电子式为 .
(5)含氮氧化物的气体可以用NH3在一定条件下进行处理,变成两种无毒的物质后排放.下列流程是探究不同催化剂对NH3还原NO反应的催化性能.

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同).为比较不同催化剂的催化性能,需要测量并记录的数据是 .在催化剂存在下NH3还原NO的化学方程式 .
查看习题详情和答案>>
(1)分析某地几年内的降雨成分发现,前些年雨水中阴离子主要以SO2-4离子为主,近几年雨水中
| NO | - 4 |
A.煤烟型
B.机动车尾气型
C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
(2)某校研究性学习小组收集到一酸雨样本,他们将样本置于敞口容器中并对样本进行一段时间的pH值测定,其测定结果见下表:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 | 6 | 6 |
| 样本的Ph | 4.93 | 4.72 | 4.63 | 4.58 | 4.56 | 4.55 | 4.55 |
(3)在工业上采用氨法烟气脱硫技术.其做法是用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合手中通入适量的氨气得到一种复合肥.氨水吸收SO2生成亚硫酸铵的化学方程式
(4)为将SO2的污染变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2和得到单质硫.该方法涉及到的化学反应有:
A.XSO2+2XCO═2xCO2+Sx
B.xCO+Sx═xCOS
C.2XCOS+xSO2═2xCO2+3Sx
其中属于氧化还原反应的是
(5)含氮氧化物的气体可以用NH3在一定条件下进行处理,变成两种无毒的物质后排放.下列流程是探究不同催化剂对NH3还原NO反应的催化性能.

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同).为比较不同催化剂的催化性能,需要测量并记录的数据是
中国“十一五”规划纲要提出节能减排(指的是减少能源浪费和降低废气排放),这是贯彻落实科学发展观、构建社会主义和谐社会的重大举措;是建设资源节约型、环境友好型社会的必然选择;是推进经济结构调整,转变增长方式的必由之路;是维护中华民族长远利益的必然要求.请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”.下列化学反应不符合“绿色化学”思想的是 .
A.制备环氧乙烷:2CH2=CH2+O2
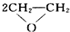
B.制备硫酸铜:Cu+2H2SO4
CuSO4+SO2↑+2H2O
C.制备甲醇:2CH4+O2
2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2],其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强.工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为 ,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因是 .
(3)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”.下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
表二:原料来源生产工艺
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因.
①从产率和产量角度分析 .
②从环境保护和能耗角度分析 .
查看习题详情和答案>>
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”.下列化学反应不符合“绿色化学”思想的是
A.制备环氧乙烷:2CH2=CH2+O2
| 催化剂 |
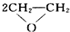
B.制备硫酸铜:Cu+2H2SO4
| ||
C.制备甲醇:2CH4+O2
| 催化剂 |
| 加热加压 |
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2],其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强.工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为
(3)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”.下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | ||||||||
| 乙炔 | CaCO3
| |||||||
| 乙烯 | 来源于石油裂解气 |
①从产率和产量角度分析
②从环境保护和能耗角度分析
国家环保总局“环境监测公报”指出,减少SO2的排放和生活废水的处理是
我国“十一五”期间环境保护的主要任务.请回答下列问题:
 (1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因
(1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因
(2)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应回收SO2,该技术较传统用NaOH溶液吸收及用H2SO4回收SO2处理方法的优点是
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2.该方法涉及到的化学反应为:SO2+2CO=2CO2+
Sx、CO+
Sx=COS、2COS+SO2=2CO2+
Sx.其中COS(羰基硫)分子的电子式为
 .
.
(4)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀.请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为
查看习题详情和答案>>
我国“十一五”期间环境保护的主要任务.请回答下列问题:
 (1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因
(1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因2H2SO3+O2=2H2SO4
2H2SO3+O2=2H2SO4
.(2)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应回收SO2,该技术较传统用NaOH溶液吸收及用H2SO4回收SO2处理方法的优点是
既能回收利用SO2,又能得到复合肥磷铵
既能回收利用SO2,又能得到复合肥磷铵
.(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2.该方法涉及到的化学反应为:SO2+2CO=2CO2+
| 1 |
| x |
| 1 |
| x |
| 3 |
| x |


(4)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀.请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为
KAl(SO4)2?12H2O或 FeSO4?7H2O
KAl(SO4)2?12H2O或 FeSO4?7H2O
.若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后在该酸性溶液中加入甲醇,NO3-和甲醇转化为两种无毒气体.请写出加入甲醇后反应的离子方程式6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O
6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O
.(2008?揭阳一模)2007年3月,温家宝总理在十届人大五次会议上指出要大力抓好节能降耗、保护环境.请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”.下列化学反应不符合“绿色化学”思想的是
A.制备环氧乙烷:2CH2=CH2+O2
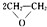
B.制备硫酸铜:Cu+2H2SO4
CuSO4+SO2↑+2H2O
C.制备甲醇:2CH4+O2
2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2]-,其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强.工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为
(3)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”.下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
表二:原料来源生产工艺
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因.
①从产率和产量角度分析
②从环境保护和能耗角度分析
查看习题详情和答案>>
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”.下列化学反应不符合“绿色化学”思想的是
BD
BD
.A.制备环氧乙烷:2CH2=CH2+O2
| 催化剂 |
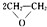
B.制备硫酸铜:Cu+2H2SO4
| ||
C.制备甲醇:2CH4+O2
| ||
| 加热、加压 |
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2]-,其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强.工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为
5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O
5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O
,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因是在酸性条件下,CN-与H+结合生成毒性很强的HCN,对人和环境造成危害
在酸性条件下,CN-与H+结合生成毒性很强的HCN,对人和环境造成危害
.(3)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”.下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
表二:原料来源生产工艺
| 原料生产工艺过程 | ||||||||
| 乙炔 | CaCO3
| |||||||
| 乙烯 | 来源于石油裂解气 |
①从产率和产量角度分析
虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多
虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多
.②从环境保护和能耗角度分析
两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得
两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得
.