网址:http://m.1010jiajiao.com/timu3_id_150113[举报]
把5 g炒干的氧化铁粉末和2 g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。

通过以上实验信息,完成下列问题:
(1)写出该反应的化学方程式:______________________;并指出_______________是氧化剂,_______________是还原剂,该反应称为______________反应。
(2)选出该实验的实验现象(将序号填写在横线上):_______________。
①镁条剧烈燃烧 ②放出大量的热,并发出耀眼的光芒 ③纸漏斗的下部被烧穿 ④熔落物能够被磁铁吸引
(3)下列物质的作用是:镁条______________________,氯酸钾_____________________。
查看习题详情和答案>>“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(将配平后的系数填在横线上)
__ C+ __ KMnO4+ ___ H2SO4→___CO2↑+ ___MnSO4 + ___K2SO4+ ___H2O?
当反应中有2.408×1024个电子发生转移时,还原剂的质量为 ????????????
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | x | 2.0 | 1.6 | 2.4 | 6 |
2 | 900 | 2.0 | 1.0 | 0.4 | 1.6 | 3 |
①实验1中以v(CO2)表示的反应速率为?? ???? ?? (要求2位有效数字,下同);实验2达到平衡时CO的体积分数为?? ????? ???? 。
②若反应的平衡常数大,处理CO的效率高,则增大该反应平衡常数的措施有????????? 。
③900℃时,该密闭容器中,加入4 molCO,3 mol H2O ,4mol CO2和2.4mol H2,比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
④一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的有?? ? 。?
A.容器中气体的平均分子量不随时间而变化???
B.消耗1molH2的同时消耗1molCO
C.容器中气体的密度不随时间而变化?????????
D.CO2的体积分数不随时间而变化????
(3)汽车尾气的排放对空气造成污染。目前采用的是在汽车排气装置中安装一个净化器,可以有效将尾气中的有害气体转化。如:
① CO (g)+NO2(g) =CO2(g) + NO (g)?? ΔH =-a kJ/mol?? (a>0)
②? 2CO (g)+2NO(g) =2CO2(g) )+ N2 (g)?? ΔH =-b kJ/mol? (b>0)
若用标准状况下3.36LCO还原NO2至N2(CO完全反应)时放出的热量为??? ??? kJ(用含a和b的代数式表示,下同);并写出该反应的热化学方程式???????????????????????????????? 。
查看习题详情和答案>>
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(将配平后的系数填在横线上)
__ C+ __ KMnO4+ ___ H2SO4→___CO2↑+ ___MnSO4 + ___K2SO4+ ___H2O
当反应中有2.408×1024个电子发生转移时,还原剂的质量为
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)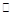 CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | x | 2.0 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2.0 | 1.0 | 0.4 | 1.6 | 3 |
①实验1中以v(CO2)表示的反应速率为 (要求2位有效数字,下同);实验2达到平衡时CO的体积分数为 。
②若反应的平衡常数大,处理CO的效率高,则增大该反应平衡常数的措施有 。
③900℃时,该密闭容器中,加入4 molCO,3 mol H2O ,4mol CO2和2.4mol H2,比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
④一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的有 。
A.容器中气体的平均分子量不随时间而变化
B.消耗1molH2的同时消耗1molCO
C.容器中气体的密度不随时间而变化
D.CO2的体积分数不随时间而变化
(3)汽车尾气的排放对空气造成污染。目前采用的是在汽车排气装置中安装一个净化器,可以有效将尾气中的有害气体转化。如:
①CO (g)+NO2(g) =CO2(g) + NO (g) ΔH =-a kJ/mol (a>0)
② 2CO (g)+2NO(g) =2CO2(g) )+ N2 (g) ΔH =-b kJ/mol (b>0)
若用标准状况下3.36LCO还原NO2至N2(CO完全反应)时放出的热量为 kJ(用含a和b的代数式表示,下同);并写出该反应的热化学方程式 。 查看习题详情和答案>>
提出问题:废液中的溶质是什么物质?
作出猜想:小红认为废液中溶质只有CaCl2.
你认为还可能含有的溶质是
查阅资料:CaCl2溶液呈中性.
实验与结论:
(1)请你写出碳酸钙和盐酸反应的化学方程式
(2)分别取少量该废液和CaCl2溶液加入到两支试管中,并向其中分别滴入无色酚酞试液做对比试验,结果两支试管中溶液均无色,于是小红认为自己的猜想是正确的.
(3)你认为小红的实验
(4)如果要证明你的猜想是正确的,你选择
(5)若实验证明了你的猜想是正确的,向废液中加入过量的
方案一:将ag铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
方案二:将
 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.020 00 mol/L的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.020 00 mol/L的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。请回答下列问题:
(1)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
____KMnO4+____FeSO4+____H2SO4=____Fe2(SO4)3+____MnSO4+____K2SO4+____H2O
(2)在滴定实验中不能选择________式滴定管,理由是________________________;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为______和_______;(铁的相对原子质量以55.9计)
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一____(填“准确”“不准确”“不一定准确”),理由是____;
②方案二____(填“准确”“不准确”“不一定准确”),理由是________。