摘要:8.在C(固)+CO2的反应中.可使反应速率加快的措施是 ①增大压强,②升高温度,③将碳粉碎,④通入CO2,⑤加入碳 A.①②⑤ B.①②③④ C.①②③ D.①②④⑤
网址:http://m.1010jiajiao.com/timu3_id_149742[举报]
下列三个反应在某密闭容器中进行:
反应①Fe(s)+CO2(g)?FeO(s)+CO(g)△H1=a kJ?mol-1
反应②2CO(g)+O2(g)?2CO2(g)△H2=b kJ?mol-1
反应③2Fe(s)+O2(g)?2FeO(s)△H3
(1)则△H3=
(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则a
A.缩小反应器体积 B.再通入CO2 C.升高温度 D.使用合适的催化剂
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定--氨的电解法合成,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2
2NH3.则在电解法合成氨的过程中,应将H2不断地通入
(5)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显
查看习题详情和答案>>
反应①Fe(s)+CO2(g)?FeO(s)+CO(g)△H1=a kJ?mol-1
反应②2CO(g)+O2(g)?2CO2(g)△H2=b kJ?mol-1
反应③2Fe(s)+O2(g)?2FeO(s)△H3
(1)则△H3=
(2a+b)kJ?mol-1
(2a+b)kJ?mol-1
(用含a、b的代数式表示)(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为
50%
50%
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则a
>
>
0(填“>”、“<”或“=”).为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有BC
BC
(填序号).A.缩小反应器体积 B.再通入CO2 C.升高温度 D.使用合适的催化剂
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定--氨的电解法合成,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2
| 通电 | 一定条件 |
阳
阳
极(填“正”、“负”、“阴”或“阳”);在另一电极通入N2,该电极反应式为N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
.(5)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显
中
中
性(填“酸”“碱”或“中”),可推断 a大于
大于
0.01(填大于、等于或小于).运用化学反应原理研究碳的氧化物的性质具有重要意义.
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高.下列措施不能够有效控制CO2所导致的温室效应的是
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8.写出84消毒液露置在空气中发生反应的离子方程式
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应.
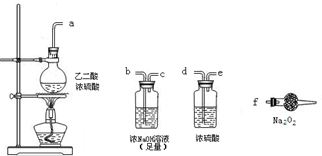
已知:H2C2O4
CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为
(4)已知C(s)+O2(g)=CO2(g),△H=-393.5kJ?mol-1;CO(g)+
O2(g)=CO2(g),△H=-283.0kJ?mol-1,写出CO2 和C(s)反应的热化学方程式
查看习题详情和答案>>
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高.下列措施不能够有效控制CO2所导致的温室效应的是
④
④
(填序号)①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8.写出84消毒液露置在空气中发生反应的离子方程式
ClO-+CO2+H2O=HClO+HCO3-;2HClO=2H++2Cl-+O2↑
ClO-+CO2+H2O=HClO+HCO3-;2HClO=2H++2Cl-+O2↑
.(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应.

已知:H2C2O4
| ||
| △ |
abcf
abcf
;若CO能够与Na2O2发生反应,则预测反应产物为Na2CO3
Na2CO3
.(4)已知C(s)+O2(g)=CO2(g),△H=-393.5kJ?mol-1;CO(g)+
| 1 |
| 2 |
CO2(g)+C(s)=2CO(g)△H=+172.5kJ?mol-1
CO2(g)+C(s)=2CO(g)△H=+172.5kJ?mol-1
.以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为CO+CO32-→2CO2+2e-
CO+CO32-→2CO2+2e-
.若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)11.2
11.2
L.
第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮.汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态.
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1mol水蒸气放热569.1kJ.则该反应的热化学方程式为______.
(2)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图,其总反应式为:H2+2NiOOH 2Ni(OH)2
2Ni(OH)2
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH______(填“增大”、“减小”或“不变”),该电极的电极反应式为______.
(3)汽车尾气的主要成分是一氧化碳和氮氧化物,治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
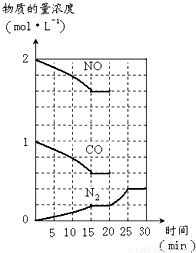
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示.则从开始到达到平衡状态的过程中,平均反应速率v(CO2)=______(结果保留两位有效数字).
若保持温度不变,20min时向容器中充入CO、N2各0.6mol,平衡将______移动(填“向左”、“向右”或“不”). 20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是______(填字母).
①加入催化剂 ②降低温度
③缩小容器体积 ④增加CO2的物质的量
A.只有①B.只有②C.只有③D.只有④

 查看习题详情和答案>>
查看习题详情和答案>>
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1mol水蒸气放热569.1kJ.则该反应的热化学方程式为______.
(2)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图,其总反应式为:H2+2NiOOH
 2Ni(OH)2
2Ni(OH)2根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH______(填“增大”、“减小”或“不变”),该电极的电极反应式为______.
(3)汽车尾气的主要成分是一氧化碳和氮氧化物,治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示.则从开始到达到平衡状态的过程中,平均反应速率v(CO2)=______(结果保留两位有效数字).
若保持温度不变,20min时向容器中充入CO、N2各0.6mol,平衡将______移动(填“向左”、“向右”或“不”). 20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是______(填字母).
①加入催化剂 ②降低温度
③缩小容器体积 ④增加CO2的物质的量
A.只有①B.只有②C.只有③D.只有④

 查看习题详情和答案>>
查看习题详情和答案>>
在汽车上安装催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)相互反应生成无毒害物质,减少汽车尾气污染。
(1)N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ/mol
写出NO(g)与CO(g)反应的热化学方程式____________________。
(2)某研究性学习小组在技术人员的指导下,在某温度时按下列流程探究催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表
(1)N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ/mol
写出NO(g)与CO(g)反应的热化学方程式____________________。
(2)某研究性学习小组在技术人员的指导下,在某温度时按下列流程探究催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表

①前2s内的平均反应速率v (N2) =__________。
②列式计算该温度下反应的平衡常数K_______________。
③对于该可逆反应,下列叙述正确的是___________(填序号)。
A.该反应在一定条件下能自发进行
B.该反应能有效减少有害气体的排放
C.该反应一旦发生将在很短的时间内完成
D.该反应达到平衡时CO、NO的转化率相等
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列叙述错误的是____(填序号)。
②列式计算该温度下反应的平衡常数K_______________。
③对于该可逆反应,下列叙述正确的是___________(填序号)。
A.该反应在一定条件下能自发进行
B.该反应能有效减少有害气体的排放
C.该反应一旦发生将在很短的时间内完成
D.该反应达到平衡时CO、NO的转化率相等
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列叙述错误的是____(填序号)。

A.负极的电极反应式为:CO+O2--2e-=CO2
B.工作时O2-在固体介质中由电极a流向电极b
C.工作时电子由电极a通过电流计流向电极b
D.电流计中显示的电流越大,汽车尾气中CO的含量越高
查看习题详情和答案>>
B.工作时O2-在固体介质中由电极a流向电极b
C.工作时电子由电极a通过电流计流向电极b
D.电流计中显示的电流越大,汽车尾气中CO的含量越高
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=
②已知:N2、O2分子中化学键的键能分别是946kJ?mol-1、497kJ?mol-1,则NO分子中化学键的键能为
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前3s内的平均反应速率v(N2)=
②在该温度下,反应的平衡常数K=
③该可逆反应△S
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是
A.负极的电极反应式为:CO+O2--2e-═CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高.
查看习题详情和答案>>
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=
-746.5 kJ?mol-1
-746.5 kJ?mol-1
.②已知:N2、O2分子中化学键的键能分别是946kJ?mol-1、497kJ?mol-1,则NO分子中化学键的键能为
631.25
631.25
kJ?mol-1.(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(×10-4mol?L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(NO)(×10-3mol?L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前3s内的平均反应速率v(N2)=
1.42×10-4
1.42×10-4
mo?L-1?s-1.②在该温度下,反应的平衡常数K=
5000
5000
.(只写出计算结果)③该可逆反应△S
<
<
0(填“>”、“<”或“=”),在低温
低温
(填“高温”、“低温”或“任何温度”)下能自发进行.
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是
B
B
A.负极的电极反应式为:CO+O2--2e-═CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高.