题目内容
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=
②已知:N2、O2分子中化学键的键能分别是946kJ?mol-1、497kJ?mol-1,则NO分子中化学键的键能为
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前3s内的平均反应速率v(N2)=
②在该温度下,反应的平衡常数K=
③该可逆反应△S
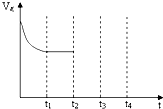
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是
A.负极的电极反应式为:CO+O2--2e-═CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高.
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=
-746.5 kJ?mol-1
-746.5 kJ?mol-1
.②已知:N2、O2分子中化学键的键能分别是946kJ?mol-1、497kJ?mol-1,则NO分子中化学键的键能为
631.25
631.25
kJ?mol-1.(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(×10-4mol?L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(NO)(×10-3mol?L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前3s内的平均反应速率v(N2)=
1.42×10-4
1.42×10-4
mo?L-1?s-1.②在该温度下,反应的平衡常数K=
5000
5000
.(只写出计算结果)③该可逆反应△S
<
<
0(填“>”、“<”或“=”),在低温
低温
(填“高温”、“低温”或“任何温度”)下能自发进行.
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是
B
B
A.负极的电极反应式为:CO+O2--2e-═CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高.
分析:(1)①依据盖斯定律结合热化学方程式计算得到;
②反应焓变=反应物键能总和-生成物键能总和;
(2)①依据化学反应速率是利用单位时间物质浓度的变化计算得到
②依据图表数据结合平衡三段式列式计算平衡浓度,依据平衡常数概念分析计算得到;
③依据原电池反应原理分析判断电极名称和电极反应,依据电极反应分析选项;
②反应焓变=反应物键能总和-生成物键能总和;
(2)①依据化学反应速率是利用单位时间物质浓度的变化计算得到
②依据图表数据结合平衡三段式列式计算平衡浓度,依据平衡常数概念分析计算得到;
③依据原电池反应原理分析判断电极名称和电极反应,依据电极反应分析选项;
解答:解:(1)①按顺序将三个热化学方程式编号为①②③,根据盖斯定律③×2-①-②可得2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ?mol-1.
故答案为:-746.5 kJ?mol-1;
②N2、O2分子中化学键的键能分别是946kJ?mol-1、497kJ?mol-1,反应焓变=反应物键能总和-生成物键能总和,N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
设NO分子中化学键的键能为x
△H=946kJ?mol-1++497kJ?mol-1-2x=+180.5kJ?mol-1
则NO分子中化学键的键能x=631.25kJ?mol-1
故答案为:631.25
(2)①v (N2)=
v (NO)=
×
=1.42×10-4mol?L-1?s-1
故答案为:1.42×10-4mol?L-1?s-1
②反应至4s达平衡,此时
c(N2)=
△c(NO)=
×(10.0×10-4 mol?L-1-1.00×10-4 mol?L-1)=4.50×10-4 mol?L-1
c(CO2)=△c(NO)=10.0×10-4 mol?L-1-1.00×10-4 mol?L-1=9.00×10-4 mol?L-1
故化学平衡常数为:K=
=
=5000L?mol-1.
故答案为:5000;
(3)A.负极的电极反应式为:CO+O2--2e-═CO2,故A正确;
B.该燃料电池的正极反应为:O2+4e-=2O2-,生成的O2-由b极向a极迁移,故B错误;
C.a电极是负极,b电极是正极,工作时电子由电极a通过传感器流向电极b,故C正确;
D.传感器中通过的电流越大,尾气中CO的含量越高,故D正确;
故答案为:B;
故答案为:-746.5 kJ?mol-1;
②N2、O2分子中化学键的键能分别是946kJ?mol-1、497kJ?mol-1,反应焓变=反应物键能总和-生成物键能总和,N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
设NO分子中化学键的键能为x
△H=946kJ?mol-1++497kJ?mol-1-2x=+180.5kJ?mol-1
则NO分子中化学键的键能x=631.25kJ?mol-1
故答案为:631.25
(2)①v (N2)=
| 1 |
| 2 |
| 1 |
| 2 |
| 10.0×10-4-1.5×10-4 |
| 3 |
故答案为:1.42×10-4mol?L-1?s-1
②反应至4s达平衡,此时
c(N2)=
| 1 |
| 2 |
| 1 |
| 2 |
c(CO2)=△c(NO)=10.0×10-4 mol?L-1-1.00×10-4 mol?L-1=9.00×10-4 mol?L-1
故化学平衡常数为:K=
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| 4.5×10-4mol/L×(9×10-4mol/L)2 |
| (1×10-4)2×(2.7×10-3)2 |
故答案为:5000;
(3)A.负极的电极反应式为:CO+O2--2e-═CO2,故A正确;
B.该燃料电池的正极反应为:O2+4e-=2O2-,生成的O2-由b极向a极迁移,故B错误;
C.a电极是负极,b电极是正极,工作时电子由电极a通过传感器流向电极b,故C正确;
D.传感器中通过的电流越大,尾气中CO的含量越高,故D正确;
故答案为:B;
点评:本题考查了热化学方程式和盖斯定律的计算应用,化学反应速率,化学平衡常数的计算应用,一点诚意了的分析判断,题目难度中等.

练习册系列答案
相关题目

 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径. CO+3H2
CO+3H2
 目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.