摘要:4份各2g的NaOH固体.分别加入100mL 下列各液体中.待足够长时间 后溶液的导电能力变化不大的是 o.6mol/LHCl (C)0.5mol/LCH3COOH溶液 (D)0.5mol/LNH4Cl溶液
网址:http://m.1010jiajiao.com/timu3_id_149539[举报]
|
下列实验操作或对实验事实的叙述正确的是________. | |
A. |
用托盘天平称取4.00 g干燥的NaOH固体,溶解于6 mL蒸馏水中,配制10% NaOH溶液;配制氢氧化铜悬浊液,在一定量硫酸铜溶液中,加入少量10%氢氧化钠溶液 |
B. |
实验室蒸馏石油时,在蒸馏烧瓶中加入一些碎瓷片,防止暴沸;冷凝管下口进冷水,上口出热水 |
C. |
钠是活泼金属,易和空气中氧气、水反应,实验室将钠保存在无水酒精中 |
D. |
煤是由无机物和有机物组成的复杂混合物,其中含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯 |
E. |
多数有机反应很慢,往往需要加热,采用水浴加热易控制温度且受热均匀,石油分馏、苯和浓硝酸发生取代反应、银镜反应、油脂水解等均必须水浴加热 |
F. |
用渗析法分离淀粉中混有的NaNO3杂质,用盐析方法提纯蛋白质 |
4份各2 g的NaOH固体,分别放入100 mL下列各液体中,等足够长时间后(不计水分挥发)溶液的导电能力变化不大的是
[ ]
A.自来水
B.0.6 mol/L HCl
C.0.5 mol/L CH3COOH溶液
D.0.5 mol/L ![]() 溶液
溶液
4份各2 g的NaOH固体,分别放入100 mL下列各液体中,等足够长时间后(不计水分挥发)溶液的导电能力变化不大的是
[ ]
A.自来水 B.0.6 mol/L HCl
C.0.5 mol/L
CH3COOH溶液 D.0.5 mol/L ![]() 溶液
溶液
实验室需要480mL0.2mol?L-1的氢氧化钠.配制方法如下:
(1)配制该溶液应选用
(2)用托盘天平准确称量
(3)将称量好的NaOH固体放在500ml大烧杯中,倒入约300ml蒸馏水,用玻璃棒搅拌,使固体全部溶解,待
(4)用少量的蒸馏水洗涤烧杯和玻璃棒
(5)向容量瓶中加入蒸馏水,至距刻度线
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是
A、所用的NaOH中混有少量NaCl B、定容时俯视液面与刻度线相切
C、转移溶液后,未洗涤烧杯和玻璃棒就进行定容 D、溶解后未冷却就转移定容
E、容量瓶使用前未干燥.
查看习题详情和答案>>
(1)配制该溶液应选用
500
500
ml的容量瓶.(2)用托盘天平准确称量
4.0
4.0
g固体NaOH.(3)将称量好的NaOH固体放在500ml大烧杯中,倒入约300ml蒸馏水,用玻璃棒搅拌,使固体全部溶解,待
冷却
冷却
后,将烧杯中的溶液注入容量瓶中.(4)用少量的蒸馏水洗涤烧杯和玻璃棒
2~3
2~3
次,洗涤后的溶液移入容量瓶中
移入容量瓶中
,轻轻振荡容量瓶,使溶液混合均匀.(5)向容量瓶中加入蒸馏水,至距刻度线
1cm~2cm
1cm~2cm
处,改用胶头滴管
胶头滴管
滴加蒸馏水至液面与刻度线相切.(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是
BD
BD
,偏低的是AC
AC
,对实验结果没有影响的是E
E
.(填各选项的序号)A、所用的NaOH中混有少量NaCl B、定容时俯视液面与刻度线相切
C、转移溶液后,未洗涤烧杯和玻璃棒就进行定容 D、溶解后未冷却就转移定容
E、容量瓶使用前未干燥.
 (1)下列实验操作或对实验事实的叙述正确的是
(1)下列实验操作或对实验事实的叙述正确的是A.用托盘天平称取4.00g干燥的NaOH固体,溶解于6ml蒸馏水中,配制10%NaOH溶液;配制氢氧化铜悬浊液,在一定量硫酸铜溶液中,加入少量10%氢氧化钠溶液.
B.实验室蒸馏石油时,在蒸馏烧瓶中加入一些碎瓷片,防止暴沸;冷凝管下口进冷水,上口出热水.
C.钠是活泼金属,易和空气中氧气、水反应,实验室将钠保存在无水酒精中.
D.煤是由无机物和有机物组成的复杂混合物,其中含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯.
E.多数有机反应很慢,往往需要加热,采用水浴加热易控制温度且受热均匀,石油分 馏、苯和浓硝酸发生取代反应、银镜反应、油脂水解均必需水浴加热.
F.用渗析法分离淀粉中混有的NaN03杂质,用盐析方法提纯蛋白质.
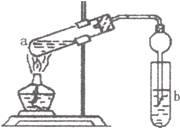
(2)如图,在试管a中先加入2mL95%的乙醇,边摇动边缓缓加入5mL浓H2S04并充分摇匀,冷却后再加入2g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入 7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
①加人浓H2S04的作用是
②试管b中观察到的主要现象是
③在实验中球形干燥管除起冷凝作用外,另一个重要作用是
④饱和Na2C03溶液的作用是