摘要:单质.氧化物.酸.碱.盐之间有一定的反应关系.可以相互转化.请将下列各类物质按其之间的反应关系连线: 金属 非金属 碱性氧化物 盐 酸性氧化物 碱 酸 [例题解析] 例1.现有下列五种物质:锌粒.硫酸锌.氢氧化锌.氧化锌.硫酸.试关于它们回答下列问题:(1)根据它们组成或性质的不同.把它们分成两大类.(2)写出它们之间转化的化学方程式. 解析:(1)对所给物质进行分类.首先应根据它们在组成.性质.状态等方面的不同.明确分类的依据.然后再针对不同的依据得出不同的分类结果.从组成上看.镁条是只含一种元素的纯净物.为单质,另四种物质都是含两种或两种以上元素的纯净物.为化合物.从状态上看.硫酸为液体.另四种物质为固体.从性质上看.硫酸镁和硫酸都是易溶物.另三种物质为难溶物.等等 (2)单质.氧化物.酸.碱.盐之间有一定的转化规律.可先明确上述物质所属物质类型.再根据此类型物质所具有的性质.写出相应的化学方程式(注意复分解反应发生的条件). 如:锌属于活泼金属.可与酸反应生成相应的盐.据此可写出反应式: Zn + H2SO4 == ZnSO4 + H2↑ , 依此类推.有:2 Zn + O2 == 2 ZnO , Zn(OH)2 + H2SO4 == ZnSO4 + 2H2O , ZnO + H2SO4 == ZnSO4 + H2O Zn(OH)2 △= ZnO + H2O , ZnO + H2 △= Zn + H2O
网址:http://m.1010jiajiao.com/timu3_id_148801[举报]
离子反应是中学化学中重要的反应类型.回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
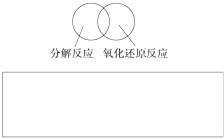
(2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下图.请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.

(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点.
查看习题详情和答案>>
(1)在发生离子反应的反应物或生成物中,一定存在有
③⑤
③⑤
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下图.请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.

(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点.
| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为:H++OH-=H2O |
离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下图.请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.
(3)有一瓶澄清的溶液,其中可能含有H+、NH+4、Mg2+、Ba2+、Al3+、I-、NO-3、CO2-3、SO2-4、AlO-2,取该溶液进行以下实验:
①取pH试纸检验,表明溶液呈强酸性.排除
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红色,可以排除
③另取部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在反应过程中均无沉淀产生,则可排除
④取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成,证明
⑤根据上述实验事实还不能确定是否存在的离子是
查看习题详情和答案>>
(1)在发生离子反应的反应物或生成物中,一定存在有
③⑤
③⑤
(填编号).①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下图.请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.

(3)有一瓶澄清的溶液,其中可能含有H+、NH+4、Mg2+、Ba2+、Al3+、I-、NO-3、CO2-3、SO2-4、AlO-2,取该溶液进行以下实验:
①取pH试纸检验,表明溶液呈强酸性.排除
CO32-、AlO2-
CO32-、AlO2-
离子存在.②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红色,可以排除
NO3-
NO3-
存在.③另取部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在反应过程中均无沉淀产生,则可排除
Mg2+、Al3+
Mg2+、Al3+
的存在.④取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成,证明
Ba2+
Ba2+
存在,又排除SO42-
SO42-
存在.⑤根据上述实验事实还不能确定是否存在的离子是
NH4+
NH4+
. A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质.处理C物质可得到有价值的化学品,写出其中1种酸和1种盐的名称
硫酸、硫酸铵(或硫酸钙等)
硫酸、硫酸铵(或硫酸钙等)
.(2)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染.B与C在一定条件下反应生成的A是大气主要成分,写出该反应的化学方程式
4NH3+6NO═5N2+6H2O(一定条件)
4NH3+6NO═5N2+6H2O(一定条件)
.(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.判断单质A的元素在周期表中的位置是
第三周期ⅢA族
第三周期ⅢA族
.写④反应离子方程式AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-
AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-
.(4)若A是太阳能电池用的光伏材料.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性.写出②反应的化学方程式
Si+2NaOH+2H2O=Na2SiO3+2H2↑
Si+2NaOH+2H2O=Na2SiO3+2H2↑
.D的化学式是Na2CO3
Na2CO3
.(5)若A是应用最广泛的金属.④反应用到A,②⑤反应均用到同一种非金属单质.C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式
Cu+2Fe3+=Cu2++2Fe2+
Cu+2Fe3+=Cu2++2Fe2+
. 离子反应是中学化学中重要的反应类型.回答下列问题:
离子反应是中学化学中重要的反应类型.回答下列问题:(1)在发生离子反应的反应物或生成物中,一定存在有
(2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示如图.请在方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.
(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点.
| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-═H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 |
2- 4 |
①
(15分)A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,甲、乙、丙为常见化合物。它们之间有如下转化关系。请回答:
(1)工业上冶炼B的常用方法为______________(填字母)
a.电解法 b.热还原法 c.热分解法
(2)丙的水溶液显 性(填酸或碱),原因是(用离子方程式表示)
。
(3)D与甲溶液反应的化学方程式 。
(4)将C单质通入KI的碱性溶液中,可生成碘盐中的一种添加剂,试写出其反应的离子方程式:__________________________________________________。
(5)一定条件下,2molB与3molD的氧化物W恰好反应,则W的化学式 。
查看习题详情和答案>>