摘要:14.将过量Cl2通入到250mLNaI溶液中.充分反应后.用小火把溶液蒸干.冷却后得到固体12g.其中25%的碘.则原NaI溶液的物质的量浓度是 ( ) A.0.62mol/L B.0.09mol/L C.0.047mol/L D.0.1mol/L
网址:http://m.1010jiajiao.com/timu3_id_148784[举报]
X、Y、Z、W是原子序数依次递增的短周期元素,4种元素的原子核外电子数之和与M元素的相对原子质量相等,M的简单离子是第3周期中离子半径最小的,W单质既能在Z2气体中燃烧,又能在无色气体YZ2中燃烧,且均生成离子化合物WZ.下列说法正确的是( )
查看习题详情和答案>>
已知2FeCl2+Cl2═2FeCl3;2NaBr+Cl2═2NaCl+Br2;6FeCl2+3Br2═2FeBr3+4FeCl3.现将少量Cl2通入到FeBr2溶液中,请选出下列选项与事实对应的化学方程式( )
查看习题详情和答案>>
某实验小组开展自主实验活动,学校实验室提供如下实验试剂和实验装置:实验试剂:
A.浓盐酸 B.稀盐酸 C.浓硫酸 D.稀硫酸 E.MnO2粉末 F.Na2SO3晶体
G.Na2SO3稀溶液 H.NaOH稀溶液 I.品红溶液
实验装置:
I.该小组拟制备Cl2和SO2两种气体,请为其选择适当的试剂和装置(用字母表示)并填入下表:
上述制备Cl2的反应的离子方程式是: .
II.该小组进一步探究Cl2和SO2两种气体的化学性质,设计如图装置.
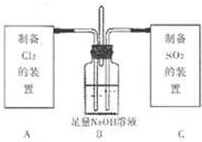
首先将C中少量SO2通入B中,请书写SO2与过量NaOH稀溶液反应的化学方程式: ;为验证此时溶液中大量存在的阴离子,该小组又设计了若干实验方案,其实验简要操作及结论是: .
待SO2与过量NaOH稀溶液反应完全后再将过量Cl2通入B中充分反应,此时溶液中一定能大量存在的阴离子是: .(不考虑空气中的CO2的影响)
查看习题详情和答案>>
A.浓盐酸 B.稀盐酸 C.浓硫酸 D.稀硫酸 E.MnO2粉末 F.Na2SO3晶体
G.Na2SO3稀溶液 H.NaOH稀溶液 I.品红溶液
实验装置:

I.该小组拟制备Cl2和SO2两种气体,请为其选择适当的试剂和装置(用字母表示)并填入下表:
| 气体 | 试剂 | 装置 |
| Cl2 | ||
| SO2 |
II.该小组进一步探究Cl2和SO2两种气体的化学性质,设计如图装置.

首先将C中少量SO2通入B中,请书写SO2与过量NaOH稀溶液反应的化学方程式:
待SO2与过量NaOH稀溶液反应完全后再将过量Cl2通入B中充分反应,此时溶液中一定能大量存在的阴离子是:
设NA代表阿伏加德罗常数,下列叙述正确的是 ( )
A.标准状况下2.24 L H2O中,分子数为0.1NA
B.将1mol Cl2通入到水中,则N(HClO)+ N(Cl‑)+ N(ClO-)= 2NA
C.常温常压下16g O2和O3混合气体中,氧原子数为NA
D.7.8g Na2O2与足量水反应,转移电子数为0.2NA
查看习题详情和答案>>
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。
该反应中还原产物是______________________;若反应过程中转移了0.2 电
电
子,则氧化产物的质量是________________________ 。
。
(2)将过量Cl2 通入 FeBr2溶液中,反应的离子方程式为:________________________;
(3)向NH4HCO3溶液中滴加少量的NaOH溶液,反应的离子方程式为______________;
(4)观察如下反应,总结规律,然后完成下列问题:
Al(OH)3 +H2O Al(OH)4- + H+ NH3+H2O
Al(OH)4- + H+ NH3+H2O NH4+
+ OH-
NH4+
+ OH-
①已知B(OH)3是一元弱酸,写出其电离方程式_____________________________
②N2H4是二元弱碱,写出其第二步电离方程式___________________ ____
查看习题详情和答案>>