题目内容
某实验小组开展自主实验活动,学校实验室提供如下实验试剂和实验装置:实验试剂:A.浓盐酸 B.稀盐酸 C.浓硫酸 D.稀硫酸 E.MnO2粉末 F.Na2SO3晶体
G.Na2SO3稀溶液 H.NaOH稀溶液 I.品红溶液
实验装置:
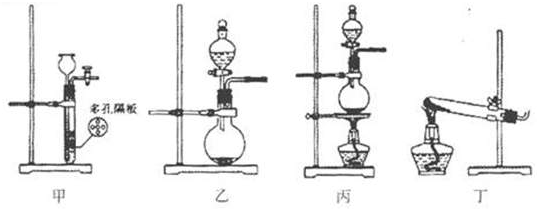
I.该小组拟制备Cl2和SO2两种气体,请为其选择适当的试剂和装置(用字母表示)并填入下表:
| 气体 | 试剂 | 装置 |
| Cl2 | ||
| SO2 |
II.该小组进一步探究Cl2和SO2两种气体的化学性质,设计如图装置.
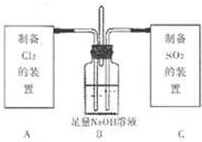
首先将C中少量SO2通入B中,请书写SO2与过量NaOH稀溶液反应的化学方程式:
待SO2与过量NaOH稀溶液反应完全后再将过量Cl2通入B中充分反应,此时溶液中一定能大量存在的阴离子是:
分析:Ⅰ、分析:依据气体制备的试剂和原理分析,制备氯气需要浓盐酸和二氧化锰加热反应制备;制备二氧化硫气体用浓硫酸和亚硫酸钠固体反应生成;
依据制备气体的试剂状态,反应条件分析判断,固体+液体加热制气体的装置选择丙;固体+固体加热制气体的装置选择丁;固体+液体不加热制气体装置且随时进行随时停止的装置选甲;固体+液体不加热制气体的装置乙;
Ⅱ、少量二氧化硫溶于氢氧化钠溶液中反应生成亚硫酸钠和水;实验验证亚硫酸根离子,可以利用亚硫酸根离子和酸反应生成的二氧化硫具有漂白性证明;待SO2与过量NaOH稀溶液反应完全后再将过量Cl2通入B中充分反应,Na2SO3+Cl2+H2O=Na2SO4+2HCl,依据化学反应产物判断阴离子.
依据制备气体的试剂状态,反应条件分析判断,固体+液体加热制气体的装置选择丙;固体+固体加热制气体的装置选择丁;固体+液体不加热制气体装置且随时进行随时停止的装置选甲;固体+液体不加热制气体的装置乙;
Ⅱ、少量二氧化硫溶于氢氧化钠溶液中反应生成亚硫酸钠和水;实验验证亚硫酸根离子,可以利用亚硫酸根离子和酸反应生成的二氧化硫具有漂白性证明;待SO2与过量NaOH稀溶液反应完全后再将过量Cl2通入B中充分反应,Na2SO3+Cl2+H2O=Na2SO4+2HCl,依据化学反应产物判断阴离子.
解答:解:Ⅰ、制备氯气需要浓盐酸和二氧化锰加热反应制备,试剂选择AE,制备氯气是固体+液体加热制气体,选择的装置为丙,制备反应的离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;制备二氧化硫气体用浓硫酸和亚硫酸钠固体反应生成,试剂选择CF,二氧化硫气体制备是固体+液体不加热制气体选择的装置为乙;
故答案为:AE,丙;CF,乙;MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
Ⅱ、SO2与过量NaOH稀溶液反应的化学方程式:H2SO3+2NaOH=Na2SO3+H2O,验验证亚硫酸根离子,可以利用亚硫酸根离子和酸反应生成的二氧化硫具有漂白性证明,设计的步骤为:取少量B中溶液于试管中,加入足量稀硫酸,将产生的气体通入品红溶液中,若溶液由红色变为无色,则证明存在SO32-;待SO2与过量NaOH稀溶液反应完全后再将过量Cl2通入B中充分反应,Na2SO3+Cl2+H2O=Na2SO4+2HCl,此时一定大量存在的阴离子为Cl-、SO42-;
故答案为:H2SO3+2NaOH=Na2SO3+H2O,取少量B中溶液于试管中,加入足量稀硫酸,将产生的气体通入品红溶液中,若溶液由红色变为无色,则证明存在SO32-; Cl-、SO42-;
| ||
故答案为:AE,丙;CF,乙;MnO2+4H++2Cl-
| ||
Ⅱ、SO2与过量NaOH稀溶液反应的化学方程式:H2SO3+2NaOH=Na2SO3+H2O,验验证亚硫酸根离子,可以利用亚硫酸根离子和酸反应生成的二氧化硫具有漂白性证明,设计的步骤为:取少量B中溶液于试管中,加入足量稀硫酸,将产生的气体通入品红溶液中,若溶液由红色变为无色,则证明存在SO32-;待SO2与过量NaOH稀溶液反应完全后再将过量Cl2通入B中充分反应,Na2SO3+Cl2+H2O=Na2SO4+2HCl,此时一定大量存在的阴离子为Cl-、SO42-;
故答案为:H2SO3+2NaOH=Na2SO3+H2O,取少量B中溶液于试管中,加入足量稀硫酸,将产生的气体通入品红溶液中,若溶液由红色变为无色,则证明存在SO32-; Cl-、SO42-;
点评:本题考查了实验室制备气体的试剂和装置选择,离子检验方法,注意制备气体的反应物状态和反应条件是解题关键,题目难度中等.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究:
【查阅资料】2KNO3
2KNO2↑+O2↑ Fe(NO3)2
FexOy+NO2↑+O2↑
实验一:探究Fe(NO3)2热分解固体产物中Fe元素的价态.该小组甲同学将分解后的固体产物溶于足量的稀
H2SO4得到相应两份溶液,进行以下探究实验.
(1)【提出猜想】
猜想一:Fe元素只显+2价;
猜想二:Fe元素 ;
猜想三:Fe元素既有+2价又有+3价.
【实验操作】①向一份溶液中滴入KSCN溶液;②向另一份溶液中滴入酸性KMnO4稀溶液.
(2)【实验现象】实验① ;实验② .
(3)【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是 .
实验二:
(4)探究Fe(NO3)2热分解气体产物的性质.小组乙同学进行了如下实验,请完成实验空缺部分内容.限选试剂和用晶:浓 H2SO4%溶液、4mol/LNaOH溶液、0.1mol/LBaC12溶液、带火星的木条、0.1mol/L酸性KMnO4溶液、蒸馏水.
实验三:
(5)KNO3中混有Fe(NO3)2,为确定其中铁元素的含量,小组丙同学进行如下实验:
①取混合物样品 10g,充分加热分解;
②将固体产物溶解、过滤,取沉淀进行洗涤、干燥,称得其质量为 3.2g. 则混合物中铁元素的含量为 .
【查阅资料】2KNO3
| △ |
| △ |
实验一:探究Fe(NO3)2热分解固体产物中Fe元素的价态.该小组甲同学将分解后的固体产物溶于足量的稀
H2SO4得到相应两份溶液,进行以下探究实验.
(1)【提出猜想】
猜想一:Fe元素只显+2价;
猜想二:Fe元素
猜想三:Fe元素既有+2价又有+3价.
【实验操作】①向一份溶液中滴入KSCN溶液;②向另一份溶液中滴入酸性KMnO4稀溶液.
(2)【实验现象】实验①
(3)【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是
实验二:
(4)探究Fe(NO3)2热分解气体产物的性质.小组乙同学进行了如下实验,请完成实验空缺部分内容.限选试剂和用晶:浓 H2SO4%溶液、4mol/LNaOH溶液、0.1mol/LBaC12溶液、带火星的木条、0.1mol/L酸性KMnO4溶液、蒸馏水.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量Fe(NO3)2固体于试管中, 加热分解. |
说明分解产生的气体中含N02. |
| 步骤2:将产生的气体依次通过盛有足量 |
说明分解产生的气体中含 02. |
(5)KNO3中混有Fe(NO3)2,为确定其中铁元素的含量,小组丙同学进行如下实验:
①取混合物样品 10g,充分加热分解;
②将固体产物溶解、过滤,取沉淀进行洗涤、干燥,称得其质量为 3.2g. 则混合物中铁元素的含量为
某实验小组开展自主实验活动,学校实验室提供如下实验试剂和实验装置:实验试剂:A.浓盐酸 B.稀盐酸 C.浓硫酸 D.稀硫酸 E.MnO2粉末F.Na2SO3晶体 G.Na2SO3稀溶液 H.NaOH稀溶液 I.品红溶液
实验装置如图1:
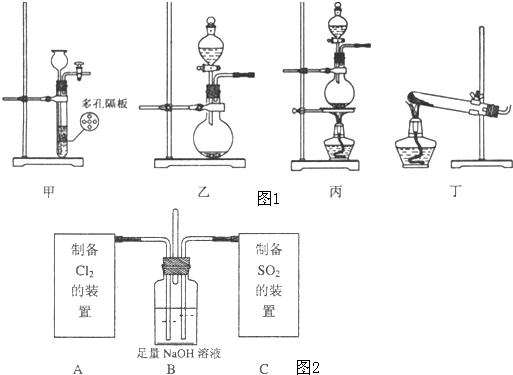
I.该小组拟制备Cl2和SO2两种气体,请为其选择适当的试剂和装置(用字母表示)并填入下表:
上述制备Cl2的反应的离子方程式是:
II.该小组进一步探究Cl2和SO2两种气体的化学性质,设计如图2装置.
首先将C中少量SO2通入B中,请书写SO2与过量NaOH稀溶液反应的化学方程式: ;待上述反应完全后再将A中Cl2通入B中充分反应,此时溶液中孝牢本旱夸李的阴离子是: .(不考虑空气中的CO2的影响)
为验证溶液中可能大量存在的阴离子,该小组又设计了若干实验方案,其中验证二价阴离子的实验简要操作及结论是: .
实验装置如图1:

I.该小组拟制备Cl2和SO2两种气体,请为其选择适当的试剂和装置(用字母表示)并填入下表:
| 气体 | 试剂 | 装置 |
| Cl2 | ||
| SO2 |
II.该小组进一步探究Cl2和SO2两种气体的化学性质,设计如图2装置.
首先将C中少量SO2通入B中,请书写SO2与过量NaOH稀溶液反应的化学方程式:
为验证溶液中可能大量存在的阴离子,该小组又设计了若干实验方案,其中验证二价阴离子的实验简要操作及结论是: