摘要:0.400mol,4.00mol/L,6.00mol/L,0.800mol,21.6g 5分(未注意有效数字者本题总共扣1分)
网址:http://m.1010jiajiao.com/timu3_id_148698[举报]
相同温度下,体积均为1.5L的两个恒容容器中发生可逆反应:X2(g)+3Y2(g)?2XY3(g)△H=-92.6kJ?mol-1,实验测得有关数据如下表:
下列叙述不正确的是( )
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3 kJ |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
| A、容器①中达到平衡时,Y2的转化率为50% | ||
| B、Q=27.78 kJ | ||
| C、若容器①体积改为1.0 L.则达平衡时放出的热量大于46.3 kJ | ||
D、容器①、②中反应的平衡常数相等,K=
|
下列是A、B、C、D、E五种短周期元素的某些性质
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是
A. B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
(2)与AD2互为等电子体的分子、离子的化学式依次为
(3)相同条件下,AD2与BD2分子两者在水中的溶解度较大的是
查看习题详情和答案>>
| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
D
D
A.
 B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3(2)与AD2互为等电子体的分子、离子的化学式依次为
N2O
N2O
、SCN-
SCN-
(各写1种)(3)相同条件下,AD2与BD2分子两者在水中的溶解度较大的是
SO2
SO2
(写分子式),理由是CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
.如图是某有色金属冶炼厂以某铜矿石(主要成分为Cu2S,且含有Fe、Zn硫化物)为原料冶炼铜的工艺流程,其冶炼过程中铜、硫回收率达到97%、87%.
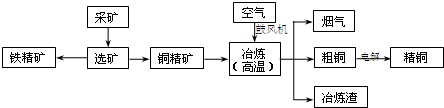
(1)冶炼精铜矿制粗铜的主要反应方程式为 ,从提高资源利用率和减排考虑,烟气中的主要废气可综合利用其制备 .
(2)以硫酸铜溶液为介质电解精炼铜时,阴极上的电极反应式为 ;电解过程中,硫酸铜溶液的浓度会 (填“变大”“不变”或“变小”).
(3)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+) 会逐渐增大而影响进一步电解.几种物质的溶度积常数(Ksp)如下:
①调节电解液的pH是除去杂质离子的常用方法.根据上表中溶度积数据判断,含等物质的量浓度 Fe2+、Zn2+、Fe3+、Cu2+的溶液,随pH升高最先沉淀下来的离子是 .
②一种方案是先加入过量的H2O2,再调节pH到4左右,加入H2O2后发生反应的离子方程式为 .
(4)为测定某铁铜合金组成比例,某同学将一定量该合金样品与某浓度的稀硝酸反应,当加入硝酸10mL,剩余金属1.8g,生成NO(标况)0.224L;再加入硝酸10mL,剩余金属0.96g,又生成NO(标况)0.224L;此时溶液中的金属离子是 ,继续加入硝酸10mL,金属恰好全部溶解,又生成NO(标况)0.224L;则该合金中铁铜的物质的量之比为 .
查看习题详情和答案>>

(1)冶炼精铜矿制粗铜的主要反应方程式为
(2)以硫酸铜溶液为介质电解精炼铜时,阴极上的电极反应式为
(3)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+) 会逐渐增大而影响进一步电解.几种物质的溶度积常数(Ksp)如下:
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| Ksp | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
②一种方案是先加入过量的H2O2,再调节pH到4左右,加入H2O2后发生反应的离子方程式为
(4)为测定某铁铜合金组成比例,某同学将一定量该合金样品与某浓度的稀硝酸反应,当加入硝酸10mL,剩余金属1.8g,生成NO(标况)0.224L;再加入硝酸10mL,剩余金属0.96g,又生成NO(标况)0.224L;此时溶液中的金属离子是
(2011?漳州一模)H2C2O4可使酸性KMnO4溶液褪色(Mn2+可作该反应的催化剂),依据褪色时间的长短可比较反应进行的快慢.下列实验中溶液褪色最快的一组是( )
| |||||||||||||||||||||||||||||||||||||||||||||
查看习题详情和答案>>
下表数据是某科研机构在某温度下测得的金属镁、锌和镍分别在氧气中进行氧化反应时,金属表面生成氧化物薄膜的实验数据记录:
(说明:a、b、c均为与温度有关的常数)
请回答下列问题:
(1)根据表中数据,分别建立金属氧化物的膜厚Y与时间t的函数关系式:
MgO: ;ZnO: .
(2)金属在一定温度下氧化腐蚀速率可以用金属氧化物薄膜的生长率来表示,计算金属锌在此高温下1-25h内的氧化腐蚀速率.氧化腐蚀速率: .
(3)为了比较三种金属的氧化腐蚀速率,实验中除了要控制相同的温度外,还应该控制的变量是 .
(4)根据表中数据绘出NiO膜厚与时间的关系曲线:
(5)综合以上信息,判断三种金属中哪种金属具有更良好的耐腐蚀性: .
查看习题详情和答案>>
| 反应时间t (h) | 1 | 4 | 9 | 16 | 25 |
| MgO膜厚Y (nm) | 0.02a | 0.08a | 0.18a | 0.32a | 0.50a |
| ZnO 膜厚Y (nm) | 1.0×10-3b | 4.0×10-3b | 9.0×10-3b | 1.6×10-2b | 2.5×10-2b |
| NiO 膜厚Y (nm) | 0.3c | 0.6c | 0.9c | 1.2c | 1.5c |
请回答下列问题:
(1)根据表中数据,分别建立金属氧化物的膜厚Y与时间t的函数关系式:
MgO:
(2)金属在一定温度下氧化腐蚀速率可以用金属氧化物薄膜的生长率来表示,计算金属锌在此高温下1-25h内的氧化腐蚀速率.氧化腐蚀速率:
(3)为了比较三种金属的氧化腐蚀速率,实验中除了要控制相同的温度外,还应该控制的变量是
(4)根据表中数据绘出NiO膜厚与时间的关系曲线:

(5)综合以上信息,判断三种金属中哪种金属具有更良好的耐腐蚀性: