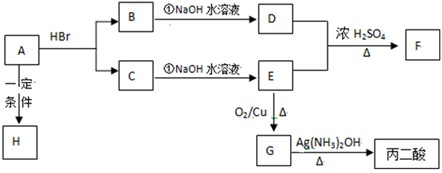
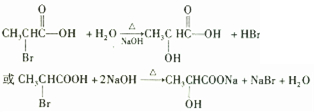
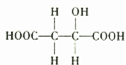
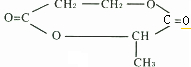题目内容
下列是A、B、C、D、E五种短周期元素的某些性质
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是
A. B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
(2)与AD2互为等电子体的分子、离子的化学式依次为
(3)相同条件下,AD2与BD2分子两者在水中的溶解度较大的是
| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
D
D
A.
 B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3(2)与AD2互为等电子体的分子、离子的化学式依次为
N2O
N2O
、SCN-
SCN-
(各写1种)(3)相同条件下,AD2与BD2分子两者在水中的溶解度较大的是
SO2
SO2
(写分子式),理由是CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
.分析:A、B、C、D、E五种短周期元素,根据元素化合价知,A属于第ⅣA族,B、D属于第ⅥA族,C、E属于第VⅡA族,B的电负性小于D,所以D是O元素,B是S元素;C的电负性小于E,所以C是Cl元素,E是F元素,硅的电负性小于S,A的电负性等于S元素,所以A是C元素,结合物质的结构、性质解答.
解答:解:A、B、C、D、E五种短周期元素,根据元素化合价知,A属于第ⅣA族,B、D属于第ⅥA族,C、E属于第VⅡA族,B的电负性小于D,所以D是O元素,B是S元素;C的电负性小于E,所以C是Cl元素,E是F元素,硅的电负性小于S,A的电负性等于S元素,所以A是C元素,
(1)A.苯环上碳原子含有3个σ 键,采用sp2杂化,故A错误;
B.甲烷分子中碳原子含有4个σ 键,采用sp3杂化,故B错误;
C.丙烯中甲基碳原子含有4个σ 键,采用sp3杂化,碳碳双键两侧的碳原子含有3个σ 键,采用sp2杂化,故C错误;
D.1-丁炔中甲基和亚甲基中碳原子含有4个σ 键,采用sp3杂化,碳碳三键两侧的碳原子含有2个σ 键,采用sp杂化,故D正确;
E.乙烷中甲基碳原子含有4个σ 键,采用sp3杂化,故E错误;
故选D;
(2)与CO2互为等电子体的分子、离子中含有3个原子,16个价电子,所以其等电子体的分子、离子的化学式依次为N2O、SCN-,故答案为:N2O、SCN-;
(3)相同条件下,CO2与SO2分子两者在水中的溶解度较大二氧化硫,二氧化碳是非极性分子,二氧化硫是极性分子,水是极性分子,根据“相似相溶”原理知,SO2在H2O中的溶解度较大,
故答案为:SO2,因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大.
(1)A.苯环上碳原子含有3个σ 键,采用sp2杂化,故A错误;
B.甲烷分子中碳原子含有4个σ 键,采用sp3杂化,故B错误;
C.丙烯中甲基碳原子含有4个σ 键,采用sp3杂化,碳碳双键两侧的碳原子含有3个σ 键,采用sp2杂化,故C错误;
D.1-丁炔中甲基和亚甲基中碳原子含有4个σ 键,采用sp3杂化,碳碳三键两侧的碳原子含有2个σ 键,采用sp杂化,故D正确;
E.乙烷中甲基碳原子含有4个σ 键,采用sp3杂化,故E错误;
故选D;
(2)与CO2互为等电子体的分子、离子中含有3个原子,16个价电子,所以其等电子体的分子、离子的化学式依次为N2O、SCN-,故答案为:N2O、SCN-;
(3)相同条件下,CO2与SO2分子两者在水中的溶解度较大二氧化硫,二氧化碳是非极性分子,二氧化硫是极性分子,水是极性分子,根据“相似相溶”原理知,SO2在H2O中的溶解度较大,
故答案为:SO2,因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大.
点评:本题考查原子杂化方式的判断、等电子体、物质的溶解性等知识点,根据价层电子对互斥理论、等电子体的概念、“相似相溶”原理来分析解答即可,难度中等.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
下列是A、B、C、D、E五中元素的某些性质:
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3 杂化方式的是
A.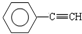 B.CH4 C.CH2=CHCH3D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3D.CH3CH2C≡CH E.CH3CH3
(2)用氢键表示式写出E的氢化物水溶液中存在的所有氢键 .
(3)相同条件下,AD2与BD2分子两者在水中的溶解度较大的是 (写分子式),理由是 ;
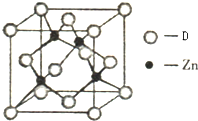
(4)如图表示某种元素D与锌形成的化合物晶胞,其中Zn和D通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 .
| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
A.
 B.CH4 C.CH2=CHCH3D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3D.CH3CH2C≡CH E.CH3CH3(2)用氢键表示式写出E的氢化物水溶液中存在的所有氢键
(3)相同条件下,AD2与BD2分子两者在水中的溶解度较大的是
(4)如图表示某种元素D与锌形成的化合物晶胞,其中Zn和D通过共价键结合,该化合物的化学式为