摘要:18.已知X.Y.Z三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序是 HZO4>H2YO4> H3YO4 .下列判断正确的是 ( ) A.3种元素阴离子还原性按X.Y.Z的顺序增强 B.单质的氧化性按X.Y.Z的顺序减弱 C.气态氢化物的稳定性按X.Y.Z的顺序增强 D.原子半径按X.Y.Z的顺序减小
网址:http://m.1010jiajiao.com/timu3_id_148662[举报]
已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.室温下元素W的单质是淡黄色粉末状固体,在空气中燃烧生成的气体是形成酸雨的主要污染物之一.元素R的单质在常温常压下是黄绿色气体,能溶于水.请回答下列问题:
(1)X元素原子基态时的电子排布式为
(2)Y元素原子的价电子的轨道表示式为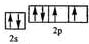
 ,该元素的名称是
,该元素的名称是
(3)X与Z可形成化合物XZ3,该化合物的空间构型为
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
(5)W、R 两元素非金属性较强的是
查看习题详情和答案>>
(1)X元素原子基态时的电子排布式为
1s22s22p63s23p63d104s24p3
1s22s22p63s23p63d104s24p3
,该元素的符号是As
As
;(2)Y元素原子的价电子的轨道表示式为


氧
氧
;(3)X与Z可形成化合物XZ3,该化合物的空间构型为
三角锥
三角锥
;(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
;(5)W、R 两元素非金属性较强的是
Cl
Cl
(写元素符号).写出能够证明这一结论的一个实验事实高氯酸的酸性强于硫酸或氯化氢的稳定性强于硫化氢
高氯酸的酸性强于硫酸或氯化氢的稳定性强于硫化氢
.X、Y、Z三种元素的原子具有相同电子层数,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
查看习题详情和答案>>
| A.非金属性:X>Y>Z |
| B.含氧酸的酸性:H3ZO4>H2YO4>HXO4 |
| C.气态氢化物的稳定性按X、Y、Z顺序由弱到强 |
| D.元素的最低负化合价的绝对值按X、Y、Z顺序由大到小 |
X、Y、Z三种元素的原子具有相同电子层数,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
A.非金属性:X>Y>Z
B.含氧酸的酸性:H3ZO4>H2YO4>HXO4
C.气态氢化物的稳定性按X、Y、Z顺序由弱到强
D.元素的最低负化合价的绝对值按X、Y、Z顺序由大到小
查看习题详情和答案>>
A.非金属性:X>Y>Z
B.含氧酸的酸性:H3ZO4>H2YO4>HXO4
C.气态氢化物的稳定性按X、Y、Z顺序由弱到强
D.元素的最低负化合价的绝对值按X、Y、Z顺序由大到小
查看习题详情和答案>>
X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:(1)Y的最高价氧化物对应水化物的化学式是 。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是: ,
此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路” b.插入电极通直流电后,有一极附近液体颜色加深 c.向该液体中加入硝酸银溶液,无沉淀产生 d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2氧化放热98.0kJ,若2mol该气体与1molO2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为: 。
②原无色有刺激性气味的气体与含1.5molY的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是: 。
查看习题详情和答案>>