摘要:今取12.7克氯化亚铁样品.完全溶于水制成溶液然后加入足量的硝酸银溶液. 使其充分反应.得氯化银沉淀.经干燥后称量质量为30克.已知.样品内杂质 为氯化物.则该杂质可能是 A.KCl B.NaCl C.ZnCl2 D.BaCl2
网址:http://m.1010jiajiao.com/timu3_id_148218[举报]
某小组同学设计实验探究Fe3+与Fe2+相互转化,实验方案及现象如下:
Ⅰ.配制FeCl2溶液
取部分变质的氯化亚铁固体[含有难溶性杂质Fe(OH)2Cl],向其中加入稀盐酸,使其完全溶解,再加入适量铁粉.
Ⅱ.实验探究Fe3+与Fe2+相互转化
实验1:0.1mol/L FeCl2溶液
无明显现象
溶液变红
实验2:0.1mol/L FeCl3溶液
溶液变红
溶液红色未褪去
(1)写出Fe(OH)2Cl与盐酸反应的离子方程式 .
(2)请用离子方程式解释实验1中滴加氯水后溶液变红的原因 .
(3)实验2的现象与预测不同,为探究可能的原因,该小组同学又进行了如下实验,方案及现象如下:
步骤1:10mL 0.1mol/L KI溶液
溶液明显变黄
步骤2:将黄色溶液分为三份:
试管1 取2mL黄色溶液
溶液变红
试管2 取3mL黄色溶液
溶液变蓝
试管3 取3mL黄色溶液
取上层溶液
溶液变蓝(比试管2中溶液颜色深)
①试管2中滴加K3[Fe(CN)6]检验的离子是 .
②黄色溶液中含有的溶质微粒有K+、Cl- 和 .
③综合上述实验现象,得出的实验结论是 .
查看习题详情和答案>>
Ⅰ.配制FeCl2溶液
取部分变质的氯化亚铁固体[含有难溶性杂质Fe(OH)2Cl],向其中加入稀盐酸,使其完全溶解,再加入适量铁粉.
Ⅱ.实验探究Fe3+与Fe2+相互转化
实验1:0.1mol/L FeCl2溶液
| 滴加KSCN溶液 |
| 滴加氯水 |
实验2:0.1mol/L FeCl3溶液
| 滴加KSCN溶液 |
| 滴加0.1mol/LKI溶液 |
(1)写出Fe(OH)2Cl与盐酸反应的离子方程式
(2)请用离子方程式解释实验1中滴加氯水后溶液变红的原因
(3)实验2的现象与预测不同,为探究可能的原因,该小组同学又进行了如下实验,方案及现象如下:
步骤1:10mL 0.1mol/L KI溶液
| 滴加6滴0.1mol/LFeCl3溶液 |
步骤2:将黄色溶液分为三份:
试管1 取2mL黄色溶液
| 滴加KSCN溶液 |
试管2 取3mL黄色溶液
| 加2滴K3[Fe(CN)6]溶液 |
试管3 取3mL黄色溶液
| 加入2mLCCl4 |
| 加2滴K3[Fe(CN)6]溶液 |
①试管2中滴加K3[Fe(CN)6]检验的离子是
②黄色溶液中含有的溶质微粒有K+、Cl- 和
③综合上述实验现象,得出的实验结论是
某小组同学设计实验探究Fe3+与Fe2+相互转化,实验方案及现象如下:
Ⅰ. 配制FeCl2溶液
取部分变质的氯化亚铁固体[含有难溶性杂质Fe(OH)2Cl],向其中加入稀盐酸,使其完全溶解,再加入适量铁粉。
Ⅱ. 实验探究Fe3+与Fe2+相互转化
实验1:
0.1 mol/L FeCl2溶液 无明显现象
无明显现象 溶液变红
溶液变红
实验2:
0.1 mol/L FeCl3溶液 溶液变红
溶液变红 溶液红色未褪去
溶液红色未褪去
写出Fe(OH)2Cl与盐酸反应的离子方程式 。
(2)请用离子方程式解释实验1中滴加氯水后溶液变红的原因 。
(3)实验2的现象与预测不同, 为探究可能的原因,该小组同学又进行了如下实验,方案及现象如下:
步骤1:10 mL 0.1 mol/L KI溶液 溶液明显变黄
溶液明显变黄
步骤2:将黄色溶液分为三份:
试管1 取2 mL黄色溶液 溶液变红
溶液变红
试管2 取3 mL黄色溶液 溶液变蓝
溶液变蓝
试管3 取3 mL黄色溶液 取上层溶液
取上层溶液 溶液变蓝(比试管2中溶液颜色深)
溶液变蓝(比试管2中溶液颜色深)
① 试管2中滴加K3[Fe(CN)6] 检验的离子是 。
② 黄色溶液中含有的溶质微粒有K+ 、Cl- 和 。
③ 综合上述实验现象,得出的实验结论是 。
查看习题详情和答案>>
某小组同学设计实验探究Fe3+与Fe2+相互转化,实验方案及现象如下:
Ⅰ.配制FeCl2溶液
取部分变质的氯化亚铁固体[含有难溶性杂质Fe(OH)2Cl],向其中加入稀盐酸,使其完全溶解,再加入适量铁粉.
Ⅱ.实验探究Fe3+与Fe2+相互转化
实验1:0.1mol/L FeCl2溶液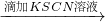 无明显现象
无明显现象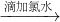 溶液变红
溶液变红
实验2:0.1mol/L FeCl3溶液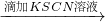 溶液变红
溶液变红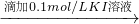 溶液红色未褪去
溶液红色未褪去
(1)写出Fe(OH)2Cl与盐酸反应的离子方程式______.
(2)请用离子方程式解释实验1中滴加氯水后溶液变红的原因______.
(3)实验2的现象与预测不同,为探究可能的原因,该小组同学又进行了如下实验,方案及现象如下:
步骤1:10mL 0.1mol/L KI溶液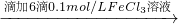 溶液明显变黄
溶液明显变黄
步骤2:将黄色溶液分为三份:
试管1 取2mL黄色溶液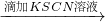 溶液变红
溶液变红
试管2 取3mL黄色溶液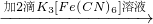 溶液变蓝
溶液变蓝
试管3 取3mL黄色溶液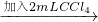 取上层溶液
取上层溶液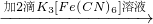 溶液变蓝(比试管2中溶液颜色深)
溶液变蓝(比试管2中溶液颜色深)
①试管2中滴加K3[Fe(CN)6]检验的离子是______.
②黄色溶液中含有的溶质微粒有K+、Cl- 和______.
③综合上述实验现象,得出的实验结论是______.
查看习题详情和答案>>
铁、铜单质及其化合物应用范围很广.现有含氯化亚铁和氯化铁杂质的氯化铜晶体(CuCl2?2H2O),为制取纯净的CuCl2?2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
请回答下列问题:
(1)检验溶液Ⅰ中Fe2+的最佳试剂为
A.KMnO4B.(NH4)2S C.H2O2 D.KSCN
(2)氧化剂X可以是
A.K2Cr2O7 B.H2O2 C.Cl2 D.浓H2SO4
(3)加入的物质Y可以是
A.CuOB.NaOH C.Cu2(OH)2CO3 D.HCl
(4)由溶液Ⅲ获得CuCl2?2H2O,需要经过
(5)欲测定溶液Ⅰ中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用
查看习题详情和答案>>

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
(1)检验溶液Ⅰ中Fe2+的最佳试剂为
A
A
,检验Fe3+的最佳试剂为D
D
.A.KMnO4B.(NH4)2S C.H2O2 D.KSCN
(2)氧化剂X可以是
B、C
B、C
(两个选项).A.K2Cr2O7 B.H2O2 C.Cl2 D.浓H2SO4
(3)加入的物质Y可以是
A、C
A、C
(两个选项).A.CuOB.NaOH C.Cu2(OH)2CO3 D.HCl
(4)由溶液Ⅲ获得CuCl2?2H2O,需要经过
蒸发浓缩
蒸发浓缩
、冷却结晶
冷却结晶
、过滤操作.(5)欲测定溶液Ⅰ中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用
酸式
酸式
(“酸式”或“碱式”)滴定管.取一定量Ⅰ溶液,用KMnO4标准溶液滴定,终点现象为溶液变浅紫色,放置一定时间后不褪色
溶液变浅紫色,放置一定时间后不褪色
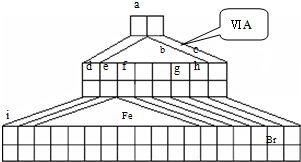
.I.如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题:
(1)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式
(2)Fe的周期位置
(3)用电子式表示元素a、g形成化合物的形成过程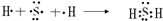
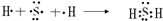 ;
;
(4)写出b元素的氢化物与b元素的最高价氧化物对应水化物反应的化学方程式
(5)d的最高价氧化物对应的水化物与f的单质反应的离子方程式
(6)a元素与碳元素形成分子的空间结构可能是(填序号)

(7)请设计实验比较e f 的金属性强弱(要求有操作、现象、结论)
(8)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和某气体,若沉淀和气体的物质的量之比为2:1,反应的离子方程式为
查看习题详情和答案>>

(1)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式
Na+[:H]-
Na+[:H]-
.(2)Fe的周期位置
第四周期第VIII族
第四周期第VIII族
(3)用电子式表示元素a、g形成化合物的形成过程
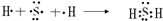
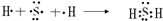
(4)写出b元素的氢化物与b元素的最高价氧化物对应水化物反应的化学方程式
NH3+HNO3═NH4NO3
NH3+HNO3═NH4NO3
(5)d的最高价氧化物对应的水化物与f的单质反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(6)a元素与碳元素形成分子的空间结构可能是(填序号)
cd
cd
.
(7)请设计实验比较e f 的金属性强弱(要求有操作、现象、结论)
取大小相等的镁条和铝条,加入到相同浓度的盐酸中,观察产生氢气的快慢,最先产生氢气的金属活泼性强,反之活泼性弱
取大小相等的镁条和铝条,加入到相同浓度的盐酸中,观察产生氢气的快慢,最先产生氢气的金属活泼性强,反之活泼性弱
.(8)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和某气体,若沉淀和气体的物质的量之比为2:1,反应的离子方程式为
3Na2O2+4H2O+2Fe2+═2Fe(OH)3+O2↑+6Na++2OH-
3Na2O2+4H2O+2Fe2+═2Fe(OH)3+O2↑+6Na++2OH-
.