摘要:用含FeS275%的硫铁矿制取硫酸.若反应过程中损失5%的硫.求制取1000kg98%的浓硫酸需这种硫铁矿多少kg.(要求写出所有反应的化学方程式) [答案]
网址:http://m.1010jiajiao.com/timu3_id_148110[举报]
工业上制硫酸的主要反应如下:4FeS2+11O2═2Fe2O3+8SO2; 2SO2+O2
2SO3; SO3+H2O═H2SO4用含FeS280%的硫铁矿生成硫酸,已知该矿石的利用率为95%,SO2的转化率为90%,SO3的吸收过程中损失率为2%.求生产500t98%的硫酸需矿石的质量.(要写出简单计算过程)
查看习题详情和答案>>
| ||
A、B、C、X均属中学化学中常见的物质,且X为单质。其中副产物已被略去,例如水等。回答下列问题:
![]()
(1)若X具有强氧化性,举两例分别写出对应的A、B、C的化学式(FeS2不能填写)。
例1:A________________,B________________,C________________。 例2:A_____________, B______________,C______________。
(2)若X为较活泼的金属,向C的水溶液中滴加硝酸银溶液有不溶于稀硝酸的白色沉淀析出,则B可能的化学式是_______________。若将铜片和碳棒用导线连接后插入B的水溶液中,构成原电池,写出负极的电极反应式:__________________________________________。
(3)若上述(2)中C溶液保存时需加入少量X,理由是____________________________。
(4)若A是一种常见的无机化合物,请写出反应①的化学方程式:(只要求写一例)
____________________________________________________________________。
(5)某工厂用含FeS260%的硫铁矿通过上述途径制取硫酸。已知反应①中S的损失率为2%,反应②中S的转化率为90%,则100 t硫铁矿可生产98%的浓硫酸__________吨。
查看习题详情和答案>>
工业上制硫酸的主要反应如下:4FeS2+11O2═2Fe2O3+8SO2; 2SO2+O2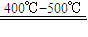 2SO3; SO3+H2O═H2SO4用含FeS280%的硫铁矿生成硫酸,已知该矿石的利用率为95%,SO2的转化率为90%,SO3的吸收过程中损失率为2%.求生产500t98%的硫酸需矿石的质量.(要写出简单计算过程)
2SO3; SO3+H2O═H2SO4用含FeS280%的硫铁矿生成硫酸,已知该矿石的利用率为95%,SO2的转化率为90%,SO3的吸收过程中损失率为2%.求生产500t98%的硫酸需矿石的质量.(要写出简单计算过程)
查看习题详情和答案>>
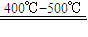 2SO3; SO3+H2O═H2SO4用含FeS280%的硫铁矿生成硫酸,已知该矿石的利用率为95%,SO2的转化率为90%,SO3的吸收过程中损失率为2%.求生产500t98%的硫酸需矿石的质量.(要写出简单计算过程)
2SO3; SO3+H2O═H2SO4用含FeS280%的硫铁矿生成硫酸,已知该矿石的利用率为95%,SO2的转化率为90%,SO3的吸收过程中损失率为2%.求生产500t98%的硫酸需矿石的质量.(要写出简单计算过程)查看习题详情和答案>>