题目内容
工业上制硫酸的主要反应如下:4FeS2+11O2═2Fe2O3+8SO2; 2SO2+O2
2SO3; SO3+H2O═H2SO4用含FeS280%的硫铁矿生成硫酸,已知该矿石的利用率为95%,SO2的转化率为90%,SO3的吸收过程中损失率为2%.求生产500t98%的硫酸需矿石的质量.(要写出简单计算过程)
| ||
设矿石的质量为x,
FeS2 ~~~~~~~~2H2SO4
120t 2×98t
80%×95%×90%×(1-2%)x 500t×98%
解之得:x=447.5t,
答:生产500t98%的硫酸需矿石的质量447.5t.
FeS2 ~~~~~~~~2H2SO4
120t 2×98t
80%×95%×90%×(1-2%)x 500t×98%
解之得:x=447.5t,
答:生产500t98%的硫酸需矿石的质量447.5t.

练习册系列答案
相关题目
单质钛的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法制取二氧化钛,再由二氧化钛制金属钛,主要反应有:
①FeTi03+3H2SO4=Ti(SO4)2+FeSO4+3H2O ②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4
③H2TiO3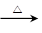 TiO2+H2O ④TiO2+2C+2Cl2
TiO2+H2O ④TiO2+2C+2Cl2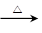 TiCl4↑+CO↑
TiCl4↑+CO↑
⑤TiCl4+2Mg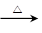 2MgCl2+Ti
2MgCl2+Ti
下列叙述错误的是( )
| A.反应①属于非氧化还原反应 |
| B.反应②是水解反应 |
| C.反应④中二氧化钛是氧化剂 |
| D.反应⑤表现了金属镁还原性比金属钛强 |